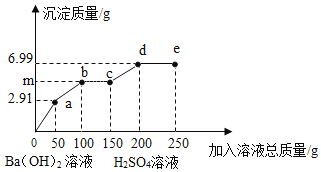
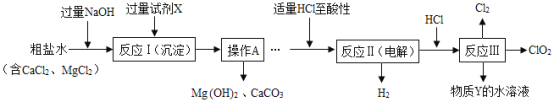
题目内容
【题目】某化学实验小组在验证酸碱盐的化学性质时,做如图所示的实验
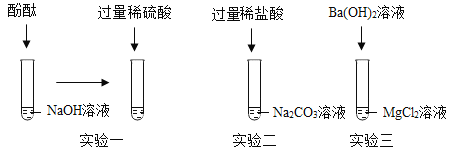
(1)实验一能够观察到的明显现象是_____。
(2)实验二发生反应的化学方程式为___。
(3)将上述试验后三只试管中所有的物质倒入一个烧杯中,充分混合后过滤。得到白色固体A和无色溶液B,向滤液B中滴加少量Ba(OH)2溶液,无现象,综上所述,固体A的成分是____,溶液B中除酚酞外,一定还含有的溶质是____。
【答案】溶液由无色变成红色,再由红色变为无色 Na2CO3+2HCl=2NaCl+H2O+CO2↑ BaSO4 NaCl、HCl、MgCl2
【解析】
(1)实验一:酚酞遇碱性溶液变红,与酸性溶液为无色,氢氧化钠与稀硫酸反应产生硫酸钠,硫酸过量,混合溶液显酸性,则能够观察到的明显现象是溶液由无色变成红色,再由红色变为无色。
(2碳酸钠与稀盐酸反应产生氯化钠、水和二氧化碳的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)实验一:氢氧化钠与过量的稀硫酸反应产生硫酸钠溶液,剩余稀硫酸;
实验二:过量的稀盐酸与碳酸钠反应产生氯化钠溶液,剩余稀盐酸;
实验三:氢氧化钡与氯化镁反应产氢氧化镁沉淀和氯化钡溶液,还可能还有氢氧化钡或氯化镁;
将上述试验后三只试管中所有的物质倒入一个烧杯中,充分混合后过滤。得到白色固体A和无色溶液B,白色固体A可能为:硫酸钡沉淀或氢氧化镁沉淀;溶液B中含有酚酞为无色,则说明溶液显酸性(或中性);向滤液B中滴加少量Ba(OH)2溶液,无现象,说明溶液B中没有稀硫酸和硫酸钠,因为氢氧化钡与稀硫酸(或硫酸钠)都能产生硫酸钡沉淀,溶液B中没有氯化镁,因为氯化镁与氢氧化钡反应产生氢氧化镁沉淀,加入少量的氢氧化钡(显碱性)溶液不变色,说明溶液显酸性,一定有盐酸;则白色固体A是硫酸钡(不溶于酸);不是氢氧化镁,因为氢氧化镁的能与酸反应,综上所述,固体A的成分是:硫酸钡,溶液B中除酚酞外,一定还含有的溶质是:氯化钠、氯化镁、氯化氢。

 阅读快车系列答案
阅读快车系列答案