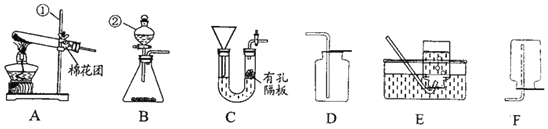
题目内容
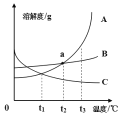
【题目】向一定质量的Na2SO4、MgSO4混合溶液中先后滴加150.0g 3.42%的稀Ba(OH)2溶液、100.0g稀H2SO4,产生沉淀的质量与滴加的溶液质量关系如下图所示。下列说法不正确的是( )
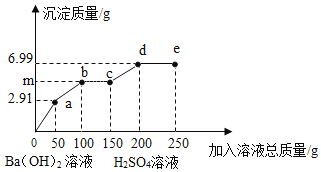
A. a点沉淀的成分为一种
B. 向e点所得溶液中滴加紫色石蕊试液,溶液呈红色
C. m=5.24
D. 所用稀H2SO4的质量分数为3.92%
【答案】AD
【解析】
根据第一个拐点在消耗50.0g3.42%的稀Ba(OH)2溶液处,可知此段是氢氧化钡和硫酸钠以及硫酸镁反应生成硫酸钡和氢氧化镁。
设生成的氢氧化镁的质量为x,生成的硫酸钡的质量为y
Mg(OH)2~Ba(OH)2~BaSO4↓
58 171233
x50.0g×3.42%y
![]()
x=0.58g
y=2.33g
所以此时沉淀的总质量为0.58g+2.33g=2.91g
由于50.0g氢氧化钡对应的硫酸钡是2.33g,则150.0g氢氧化钡溶液对应的硫酸钡的质量为6.99g,而加入硫酸50.0g也对应2.33g硫酸钡,所以a-b段是氢氧化钡只和硫酸钠反应,到b点时硫酸钠完全反应,之后是氢氧化钡过量。
所以m点是继续在2.91g的基础上继续生成硫酸钡,且是50.0g氢氧化钡对应的硫酸钡是2.33g,所以m=2.91g+2.33g=5.24g
由于加入硫酸50.0g也对应2.33g硫酸钡,所以设所用稀H2SO4的质量分数为z
H2SO4∽BaSO4↓
98233
50.0gz2.33g
![]()
z=1.96%
d点氢氧化钡恰好完全反应,所以之后是硫酸过量,即之后溶液呈酸性,所以向e点所得溶液中滴加紫色石蕊试液,溶液呈红色。
故选:AD。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】下列实验方案中合理的是( )
选项 | 实验目的 | 实验操作 |
A | 分离 | 用足量的水溶解,过滤 |
B | 制取少量的 | 用 |
C | 除去 | 将气体依次通过过量的石灰水、浓硫酸 |
D | 鉴别 | 分别取样,滴加酚酞溶液 |
A. AB. BC. CD. D