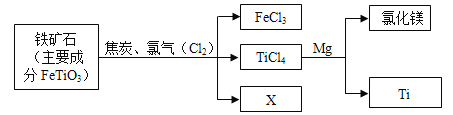
题目内容
【题目】工业上用菱锰矿[主要成分为MnCO3,含FeCO3、Cu2(OH)2CO3、SiO2等杂质]为原料来制取二氧化锰,其生产流程示意图如下:
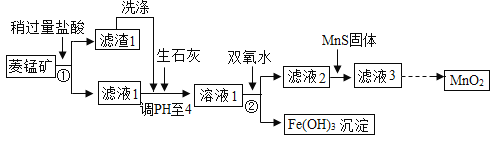
回答下列问题:
(1)加盐酸之前,需要将菱锰矿粉碎,目的是________
(2)操作②是______,此操作过程中用的玻璃仪器有玻璃棒、______、 _______,其中玻璃棒的作用是________。
(3)向菱锰矿中加入盐酸,MnCO3、FeCO3、Cu2(OH)2CO3都溶解并转化为MnCl2、FeCl2、CuCl2。盐酸与MnCO3反应的化学方程式为_______________。滤渣1主要成分是二氧化硅,需要洗涤,洗涤的目的是________________,可以通过在最后一次洗涤液中滴加________(填化学式)溶液,若无明显现象,则已洗涤干净。
(4)加入双氧水将铁元素转化为Fe(OH)3沉淀,其反应为:2FeCl2 + H2O2 + 4H2O = 2Fe(OH)3↓ + 4HCl,该反应化合价发生变化的元素是氧和________(填元素名称)。
(5)加入Na2S、MnS等硫化物,均可将MnCl2中混有的CuCl2转化为CuS沉淀除去,但实际生产中选用MnS,其原因是________。
【答案】增大反应物的接触面积,加快反应速率,使反应更充分 过滤 烧杯 漏斗 引流 ![]() 回收滤渣表面的MnCl2(答案合理即可) AgNO3 铁 不引入新杂质
回收滤渣表面的MnCl2(答案合理即可) AgNO3 铁 不引入新杂质
【解析】
(1)将菱锰矿粉碎,可以增大反应物之间的接触面积,提高反应速率,使反应更充分;
(2)操作②实现了固液分离,故操作②是过滤。过滤需要用到的玻璃仪器有:玻璃棒、烧杯、漏斗,玻璃棒的作用是:引流;
(3)盐酸与MnCO3反应生成氯化锰、二氧化碳和水,该反应的化学方程式为:![]() ;
;
向菱锰矿中加入盐酸,MnCO3、FeCO3、Cu2(OH)2CO3都溶解并转化为MnCl2、FeCl2、CuCl2,且该生产流程是生成二氧化锰,故洗涤滤渣的目的是:回收滤渣表面的MnCl2;
滤液中含有氯离子,银离子能与氯离子反应生成氯化银白色沉淀,故可以通过在最后一次洗涤液中滴加AgNO3溶液,若无明显现象,则已洗涤干净;
(4)氯化亚铁中铁元素的化合价为+2价,氢氧化铁中铁元素的化合价为+3价,故铁元素的化合价发生了改变;
(5)加入Na2S,Na2S与氯化铜反应生成CuS和氯化钠,虽然除去了氯化铜,但是引入了新的杂质氯化钠,如果用MnS,MnS与氯化铜反应生成CuS和氯化锰,不会引入新的杂质,故填:不引入新杂质。

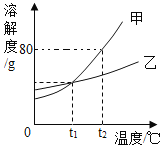
【题目】甲、乙、丙三种物质间的反应如图所示,下列选项不符合图示反应关系的是
选项 | 甲 | 乙 | 丙 |
A | C | CO | CO2 |
B | Fe2O3 | Fe | FeSO4 |
C | CuSO4 | Cu(OH)2 | CuCl2 |
D | Na2CO3 | CaCO3 | CO2 |
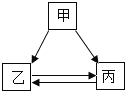
A.AB.BC.CD.D