题目内容
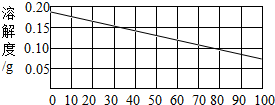
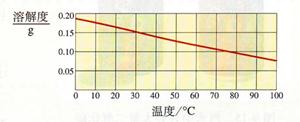
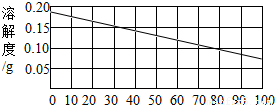
 22、熟石灰的溶解度如下图所示.某同学在30℃时用固体熟石灰配制了饱和澄清石灰水溶液.取少量溶液于试管中,滴加酚酞试剂,溶液变红色.
22、熟石灰的溶解度如下图所示.某同学在30℃时用固体熟石灰配制了饱和澄清石灰水溶液.取少量溶液于试管中,滴加酚酞试剂,溶液变红色.(1)滴加酚酞试剂,溶液变红色,说明溶液显
碱
性(填酸、碱、中).(2)30℃时,100g水中溶解熟石灰的质量为
0.15g
(3)将溶液的温度从30℃迅速升高100℃,则该溶液
AD
A.仍是饱和溶液 B.是不饱和溶液 C.氢氧化钙的质量增大
D.氢氧化钙的质量减小 E.氢氧化钙的质量不变
(4)盛有饱和澄清石灰水溶液的烧杯在空气煮沸一段时间后,冷却至室温.烧杯壁上和烧杯底部有白色固体;取出少量烧杯中的清液,滴加酚酞试剂,溶液变红色.据你推测:白色固体的成分可能是
Ca(OH)2
导致溶液变红色的原因是
溶液中仍有未结晶析出的氢氧化钙,从而溶液呈碱性
分析:根据氢氧化钙的溶解度曲线可知:①查出氢氧化钙在某温度下的溶解度,②氢氧化钙的溶解度随温度的升高而减小,温度升高,溶解度就会减小,饱和溶液就会有晶体析出,从而导致溶液出现一系列的变化.固体的溶解度是指在一定的温度下,某固体物质在100克溶剂中达到饱和状态时所溶解的质量.
解答:解:(1)由于氢氧化钙溶液有OH-,溶液呈碱性,因此可以是无色酚酞变红,故答案为:碱性
(2)根据氢氧化钙的溶解度曲线图,不难查出,在30℃时,氢氧化钙的溶解度是0.15g,即在100克水中最多溶解0.15g氢氧化钙,故答案为:0.15g
(3)由于氢氧化钙的溶解度随温度的升高而减小,因此将氢氧化钙的饱和溶液由从30℃迅速升高100℃,溶液中就会有晶体析出,因此溶液中的溶质就会减少,则溶液中溶质的质量分数也会减小,故答案为:A、D
(4)由于氢氧化钙的溶解度随温度的升高而减小,因此给饱和溶液煮沸时,就会有氢氧化钙从溶液中结晶析出,但氢氧化钙不会从溶液中全部结晶析出,故答案为:Ca(OH)2,溶液中仍有未结晶析出的氢氧化钙,从而溶液呈碱性.
(2)根据氢氧化钙的溶解度曲线图,不难查出,在30℃时,氢氧化钙的溶解度是0.15g,即在100克水中最多溶解0.15g氢氧化钙,故答案为:0.15g
(3)由于氢氧化钙的溶解度随温度的升高而减小,因此将氢氧化钙的饱和溶液由从30℃迅速升高100℃,溶液中就会有晶体析出,因此溶液中的溶质就会减少,则溶液中溶质的质量分数也会减小,故答案为:A、D
(4)由于氢氧化钙的溶解度随温度的升高而减小,因此给饱和溶液煮沸时,就会有氢氧化钙从溶液中结晶析出,但氢氧化钙不会从溶液中全部结晶析出,故答案为:Ca(OH)2,溶液中仍有未结晶析出的氢氧化钙,从而溶液呈碱性.
点评:本题难度不是很大,主要考查了固体溶解度曲线的意义和固体溶解度的概念,培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目