题目内容
【题目】生活、生产中处处有化学,化学就在我们身边。
(1)《生活饮用水标准》中规定水的总硬度(以碳酸钙计)不超过 450mg/L,测得某水样的硬度为600mg/L,则1吨该水样中含有钙的质量约为________克,生活中常用肥皂水来区分硬水和软水,鉴别时加入肥皂水观察到的现象为________,长期饮用硬水对人体健康不利,生活中降低水的硬度可采用的方法是________;
(2)炒菜时油锅中的油不慎着火,用锅盖将其盖灭的原理是________。
(3)常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有________功能;
(4)生产电动汽车需要消耗大量的钢铁,写出工业上以磁铁矿(主要成分是四氧化三铁)为原料炼铁的化学反应方程式________,钢铁车身喷漆处理既美观又防锈,喷漆防锈的原理是________。
(5)对 Ag、Fe、Cu 三种金属活动性顺序的探究,下列所选试剂你认为不可行的是________
A.Fe、Ag、CuSO4 溶液 B.Cu、Ag、FeSO4 溶液
C.Fe、Cu、AgNO3 溶液 D.Cu、FeSO4 溶液、AgNO3 溶液
【答案】240 浮渣多,泡沫少 煮沸 隔绝氧气(或隔绝空气) 乳化 Fe3O4+4CO![]() 3Fe+4CO2 隔绝氧气和水蒸气 B
3Fe+4CO2 隔绝氧气和水蒸气 B
【解析】
(1)测得某水样的硬度为600mg/L,则1吨该水样中含有碳酸钙的质量=600 mg/L×1000L=600000mg= 600g,钙的质量约为![]() ,生活中常用肥皂水来区分硬水和软水,鉴别时加入肥皂水观察到的现象为浮渣多,泡沫少;天然水煮沸时,水中可溶性钙、镁化合物转化为沉淀,水的硬度降低。长期饮用硬水对人体健康不利,生活中降低水的硬度可采用的方法是煮沸;
,生活中常用肥皂水来区分硬水和软水,鉴别时加入肥皂水观察到的现象为浮渣多,泡沫少;天然水煮沸时,水中可溶性钙、镁化合物转化为沉淀,水的硬度降低。长期饮用硬水对人体健康不利,生活中降低水的硬度可采用的方法是煮沸;
(2)炒菜时油锅中的油不慎着火,用锅盖将其盖灭的原理是隔绝氧气(或隔绝空气;
(3)常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有乳化功能;
(4)磁铁矿(主要成分是四氧化三铁)与一氧化碳在高温条件下反应生成铁和二氧化碳,化学反应方程式为:Fe3O4+4CO![]() 3Fe+4CO2;钢铁车身喷漆处理既美观又防锈,喷漆防锈的原理是隔绝氧气和水蒸气;
3Fe+4CO2;钢铁车身喷漆处理既美观又防锈,喷漆防锈的原理是隔绝氧气和水蒸气;
(5)A、铁与CuSO4溶液反应置换出铜,说明了活动性铁>铜;银与CuSO4溶液不反应,说明了活动性铜>银;由此可得出三种金属活动性镁>铁>铜,故该方案合理;
B、Cu、Ag均不能与硫酸亚铁溶液反应,说明了活动性铁>铜,铁>银,但无法确定银和铜的活动性强弱,故该方案不合理;
C、Cu与AgNO3反应生成银和硝酸铜,说明了活动性铜>银;等硝酸银完全反应后,再将Fe放入上一步生成的硝酸铜溶液中可置换出铜,说明了活动性铁>铜,故该方案合理;
D、Cu不能FeSO4 溶液反应,说明了活动性铁>铜;Cu能与AgNO3 溶液反应生成银和硝酸铜,说明了活动性铜>银;由此可得出三种金属活动性镁>铁>铜,故该方案合理。故选B。

 53天天练系列答案
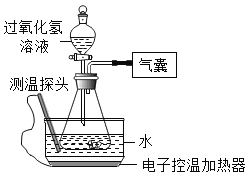
53天天练系列答案【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。(实验装置如图所示,夹持仪器已略去)
(猜想与假设)
影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂用量。
(实验记录)
同学们进行6组实验,实验记录如下:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的 浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的 体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | 0.1g MnO2 | 0.5g MnO2 | ||||
6min内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是________mL。
(2)实验①-⑥可以通过测定__________来比较过氧化氢的分解速率。
A 相同时间内产生氧气的体积
B 产生相同体积的氧气所需时间
C 相同时间内产生氧气的质量
(3)得出“过氧化氢溶液的浓度越大分解速率越快”结论所依据的实验是____(填序号)。
(4)通过实验①、②、④可得出的结论是_________。
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是________(答一点即可)
【题目】有些食品袋里装有一小袋铁粉作保鲜剂,化学兴趣小组对一包使用过且已经生锈的保鲜剂进行探究。
(提出猜想)保鲜剂可能的组成:①只有 Fe2O3; ②Fe和 Fe2O3的混合物。
(实验探究 1)探究已使用过的保鲜剂的成份
(1)取保鲜剂样品少量于试管中,加入过量稀盐酸,小组同学根据观察到的现象一致认为猜想②成立,他们观察到的现象是______。
(实验探究 2)保鲜剂中 Fe2O3含量的探究
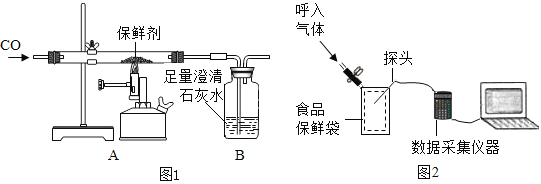
称取保鲜剂样品 1.0g 装入硬质玻璃管中,按图1所示的装置进行实验。开始时缓缓通入CO 气体,过一段时间后再加热使其充分反应,待反应完全后,继续通 CO 气体直至玻璃管冷却。
(2)先通入CO气体一段时间后再加热的目的是______。
(3)反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应后 |
玻璃管和保鲜剂的总质量 | 玻璃管和固体物质的总质量为 |
①装置中发生反应的化学方程式为__________________。
②分析表中的数据后,得出保鲜剂与反应后固体质量差值0.21g是______![]() 填标号
填标号![]() 。
。
a保鲜剂中铁的质量
b保鲜剂中氧化铁的质量
c保鲜剂中氧化铁与通过反应生成的铁的质量差
反应完全后,继续通 CO 气体直至玻璃管冷却,目的是______(任意写一条)。
(4)(反思评价)图1中装置存在的不足之处是_________。
(附加题)(注意:正确回答下列问题加4分,总分不超过60分)
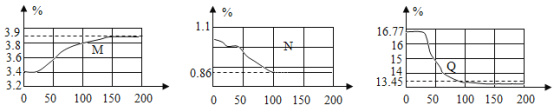
(实验探究)在如下图所示,保鲜袋中装有保鲜剂,将O2、CO2、湿度(测水蒸气)传感器探头放入保鲜袋中(有少量空气),然后快速向袋内呼出气体直到吹满,再打开仪器开始采集数据。采集的数据如下图所示,纵坐标均为某气体体积分数(%),横坐标均为时间(s)。据图回答下列问题:
(1)表示O2体积分数变化的曲线是______(选填“M”、“N”、“Q”),指出曲线N在0~50s内下降的原因______。
(2)查阅文献得知其他人员使用铁的缓慢氧化原理来测量封闭容器内的氧气含量时,可以将氧气消耗至大约1%,但此处氧气剩余含量明显偏高,试解释原因______(写出一条即可)。
(3)实验中,没有生成二氧化碳,但它的含量仍然发生了变化,请根据图像作出解释______。