题目内容
【题目】有些食品袋里装有一小袋铁粉作保鲜剂,化学兴趣小组对一包使用过且已经生锈的保鲜剂进行探究。
(提出猜想)保鲜剂可能的组成:①只有 Fe2O3; ②Fe和 Fe2O3的混合物。
(实验探究 1)探究已使用过的保鲜剂的成份
(1)取保鲜剂样品少量于试管中,加入过量稀盐酸,小组同学根据观察到的现象一致认为猜想②成立,他们观察到的现象是______。
(实验探究 2)保鲜剂中 Fe2O3含量的探究
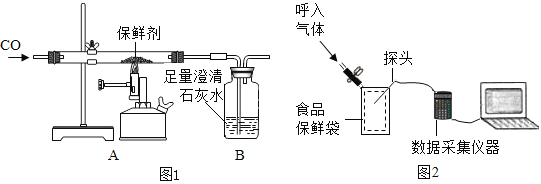
称取保鲜剂样品 1.0g 装入硬质玻璃管中,按图1所示的装置进行实验。开始时缓缓通入CO 气体,过一段时间后再加热使其充分反应,待反应完全后,继续通 CO 气体直至玻璃管冷却。
(2)先通入CO气体一段时间后再加热的目的是______。
(3)反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应后 |
玻璃管和保鲜剂的总质量 | 玻璃管和固体物质的总质量为 |
①装置中发生反应的化学方程式为__________________。
②分析表中的数据后,得出保鲜剂与反应后固体质量差值0.21g是______![]() 填标号
填标号![]() 。
。
a保鲜剂中铁的质量
b保鲜剂中氧化铁的质量
c保鲜剂中氧化铁与通过反应生成的铁的质量差
反应完全后,继续通 CO 气体直至玻璃管冷却,目的是______(任意写一条)。
(4)(反思评价)图1中装置存在的不足之处是_________。
(附加题)(注意:正确回答下列问题加4分,总分不超过60分)
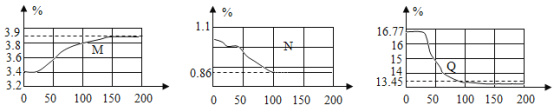
(实验探究)在如下图所示,保鲜袋中装有保鲜剂,将O2、CO2、湿度(测水蒸气)传感器探头放入保鲜袋中(有少量空气),然后快速向袋内呼出气体直到吹满,再打开仪器开始采集数据。采集的数据如下图所示,纵坐标均为某气体体积分数(%),横坐标均为时间(s)。据图回答下列问题:
(1)表示O2体积分数变化的曲线是______(选填“M”、“N”、“Q”),指出曲线N在0~50s内下降的原因______。
(2)查阅文献得知其他人员使用铁的缓慢氧化原理来测量封闭容器内的氧气含量时,可以将氧气消耗至大约1%,但此处氧气剩余含量明显偏高,试解释原因______(写出一条即可)。
(3)实验中,没有生成二氧化碳,但它的含量仍然发生了变化,请根据图像作出解释______。
【答案】有气泡冒出 排尽装置内的空气,防止爆炸 3CO+Fe2O3![]() 2Fe+3CO2 c 防倒吸或防氧化 缺少尾气处理装置 Q 水蒸气液化 保鲜剂不足,装置漏气 因为氧气和水蒸气含量减少,导致二氧化碳含量相对增加
2Fe+3CO2 c 防倒吸或防氧化 缺少尾气处理装置 Q 水蒸气液化 保鲜剂不足,装置漏气 因为氧气和水蒸气含量减少,导致二氧化碳含量相对增加
【解析】
铁和稀盐酸反应生成氯化亚铁和氢气,一氧化碳和氧化铁高温生成铁和二氧化碳。
(1)铁粉作保鲜剂,铁和稀盐酸反应生成氯化亚铁和氢气,取保鲜剂样品少量于试管中,加入过量稀盐酸,小组同学根据观察到的现象一致认为猜想②成立,观察到的现象是有气泡冒出。
(2)一氧化碳具有可燃性,先通入CO气体一段时间后再加热的目的是排尽装置内的空气,防止爆炸。
(3)①装置中发生反应是一氧化碳和氧化铁高温生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。
②由表中的数据可知,保鲜剂与反应后固体质量差值0.21g是保鲜剂中氧化铁与通过反应生成的铁的质量差,故选c。
反应完全后,继续通 CO 气体直至玻璃管冷却,目的是防倒吸或防氧化。
(4)[反思评价]一氧化碳有毒,为防止污染空气,要有尾气处理装置,图1中装置存在的不足之处是缺少尾气处理装置。
[实验探究]
(1)向袋内呼出气体直到吹满,二氧化碳的体积增加,氧气、水蒸气的体积减少,原点时,只有氧气含量可能达到16.77%,故表示O2体积分数变化的曲线是Q,指出曲线N在0~50s内下降的原因水蒸气液化。
(2)其他人员使用铁的缓慢氧化原理来测量封闭容器内的氧气含量时,可以将氧气消耗至大约1%,但此处氧气剩余含量明显偏高,原因是保鲜剂不足,装置漏气。
(3)实验中,没有生成二氧化碳,但它的含量仍然发生了变化,解释是氧气和水蒸气含量减少,导致二氧化碳含量相对增加。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案