题目内容
【题目】下表是元素周期表中第2、3周期的元素,请回答下列问题。
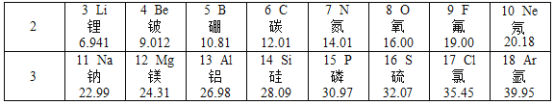
(1)下列各组具有相似化学性质的元素是_____(填字母序号)。
A Na、Cl B O、S C F、Cl D Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律_____。
(3)第7号元素与第12号元素的原子形成化合物的化学式为_____。
(4)某粒子的结构示意图为 ,当x-y=8时,该粒子的符号为
,当x-y=8时,该粒子的符号为
(5)如图中A、B分别是某微粒的结构示意图,回答下列问题:

若A是某阴离子的结构示意图,则x可能是下列中的_____(填字母序号);
A 8 B 10 C 11 D 12
若A中x=12,则A、B所表示的元素形成化合物的名称为_____。
【答案】BC 最外层电子数依次增加 Mg3N2 S2- A 氯化镁
【解析】
最外层电子数相同,化学性质相似,质子数=电子数,为原子;质子数>电子数,为阳离子;质子数<电子数,为阴离子。
(1)A、Na是金属元素,Cl是非金属元素,化学性质不相似,故A不正确;
B、O、S是同一主族元素,最外层电子数相同,化学性质相似,故B正确;
C、F、Cl是同一主族元素,最外层电子数相同,化学性质相似,故C正确;
D、Cl、Ar不是同一主族元素,最外层电子数不相同,化学性质不相似,故D不正确。故选BC。
(2)同一周期,原子的电子层数相同,最外层电子数依次增加,故第三周期元素原子的核外电子排布规律最外层电子数依次增加。
(3)第7号元素是氮元素,第12号元素是镁元素,第7号元素与第12号元素的原子形成化合物中氮元素显-3价,镁元素显+2价,故化学式为Mg3N2。
(4)粒子的结构示意图为 ,x-y=8,则x=8+y,在原子中,x =2+8+y,则粒子为离子,y=8,x=8+8=16,故当x-y=8时,该粒子为硫离子,符号为S2-。
,x-y=8,则x=8+y,在原子中,x =2+8+y,则粒子为离子,y=8,x=8+8=16,故当x-y=8时,该粒子为硫离子,符号为S2-。
(5)若A是某阴离子的结构示意图,则是最外层得到电子形成的,当x为8时,是最外层得到2个电子形成的,为氧离子;当x为10时,质子数=核外电子数,为原子;当x为11时,是失去最外层1个电子形成的,为钠离子,属于阳离子;当x为12时,是失去最外层2个电子形成的,为镁离子,属于阳离子,故选A。
若A中x=12,则A是镁元素,B是氯元素,则A、B所表示的元素形成化合物的名称为氯化镁。





