题目内容
18.化学课上,老师向盛有少量碳酸钠溶液的试管中加入一定量的澄清石灰水,出现了白色沉淀.据此现象,老师提出如下问题,请回答:(1)反应后溶液中溶质是什么?
小明认为有以下四种情况,请你替他补充完整:
情况①:NaOH情况②:NaOH和Na2CO3
情况③:NaOH和Ca(OH)2情况④:NaOH、Na2CO3和Ca(OH)2
小红认为只有三种情况,其中情况④(填序号)不可能,理由是Na2CO3和Ca(OH)2能发生反应生成沉淀,不能共存.
(2)为了进一步确定反应后溶液的成分,小强设计了如下实验方案:
实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加过量稀盐酸 | 无明显现象 | 情况②(填序号)不可能 |
| 另取少量溶液于试管中,加入碳酸钠溶液 | 生成了白色沉淀 | 情况③正确 |
分析 (1)根据题给的反应及其生成物来判断分析可能的组成;其中碳酸钠可以和氢氧化钙反应生成沉淀,故不能同时存在;
(2)根据作出的假设结合物质的性质来设计实验进行验证.
解答 解:(1)碳酸钠和氢氧化钙反应可以生成碳酸钙和氢氧化钠,所以在反应后的溶液中一定含有氢氧化钠;而小明提出的第四种假设不可能,因为碳酸钠可以和氢氧化钙生成碳酸钙沉淀;
(2)碳酸钠可以和盐酸反应生成了二氧化碳气体,而题干中在加入盐酸后没有明显现象,说明在溶液中不含碳酸钠,即情况②是不可能的;要证明情况③是正确的,则由于氢氧化钙可以和碳酸钠溶液反应生成白色沉淀,所以在这里可以加入碳酸钠溶液来根据实验现象来判断是否含有氢氧化钙.
故答案为:(1)NaOH;④;Na2CO3和Ca(OH)2能发生反应生成沉淀,不能共存;
(2)
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液与试管中,加入过量的稀盐酸 | 无明显现象 | 情况 ②(填序号)不可能 |
| 另取少量溶液于试管中,加入碳酸钠溶液 | 生成了白色沉淀 | 情况③正确 |
点评 熟练掌握碳酸钠和氢氧化钙的性质,并能够根据它们的性质来鉴别和区分这两种物质,鉴别碳酸钠常用盐酸、氯化钡、氯化钙等物质.

练习册系列答案
相关题目
9.八氯合二铼酸钾(K2Re2Cl8)是无机化学研究中的重要化合物,其中氯元素的化合价为-1,那么铼元素的化合价是( )
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
6.某同学对一瓶长期暴漏在空气中的氢氧化钠固体样品的成分及含量进行探究.
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液汇总几乎不溶解.
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
【提出问题2】怎样提纯该样品得到纯净的氢氧化钠固体?
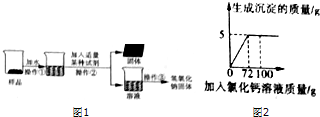
【实验探究2】为得到纯净的氢氧化钠固体,小亮明设计了如图1所示的实验流程.请回答下列问题:
(1)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)最终所得氢氧化钠固体质量大于(填“大于”、“等于”或“小于”)变质后样品中氢氧化钠的质量.
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质和除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考的问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差.
(2)向50g Na2co3溶液总逐滴加入一定溶质质量分数的CaCl2溶液,实验过程中,生成沉淀的质量与加入CaCl2溶液的质量关系如图所示,试计算:恰好完全反应时,所得溶液中溶质的质量分数.
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液汇总几乎不溶解.
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 过量CaCl2溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+CaCl2═2NaCl+CaCO3↓ |
| (2)将上述反应后的混合液过滤,取滤液加入酚酞试液; | 溶液变红色 | 证明猜想Ⅱ正确 |
【实验探究2】为得到纯净的氢氧化钠固体,小亮明设计了如图1所示的实验流程.请回答下列问题:
(1)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)最终所得氢氧化钠固体质量大于(填“大于”、“等于”或“小于”)变质后样品中氢氧化钠的质量.
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质和除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考的问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差.
(2)向50g Na2co3溶液总逐滴加入一定溶质质量分数的CaCl2溶液,实验过程中,生成沉淀的质量与加入CaCl2溶液的质量关系如图所示,试计算:恰好完全反应时,所得溶液中溶质的质量分数.

10.下列实验方案中,设计合理的是( )
| A. | 用过滤的方法将硬水进行软化 | |
| B. | 用燃烧木炭的方法制备纯净的二氧化碳 | |
| C. | 加适量稀盐酸清洗铁制品表面的铁锈 | |
| D. | 用闻气味的方法区别氧气和二氧化碳 |
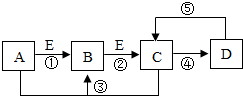 A、B、C、D、E是初中化学中常见的五种物质.在通常情况下,A为黑色粉末状固体,B、C均为无色无味的气体,D为不溶于水的白色固体,在实验室常用含D的物质与稀盐酸反应制取C,单质E是组成空气的主要成分之一.它们之间的关系如图所示(图中反应条件及反应④和⑤中某些反应物、生成物已略去).
A、B、C、D、E是初中化学中常见的五种物质.在通常情况下,A为黑色粉末状固体,B、C均为无色无味的气体,D为不溶于水的白色固体,在实验室常用含D的物质与稀盐酸反应制取C,单质E是组成空气的主要成分之一.它们之间的关系如图所示(图中反应条件及反应④和⑤中某些反应物、生成物已略去).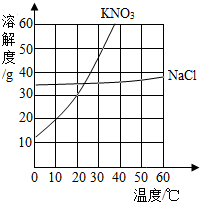 根据如图所示的溶解度曲线,回答下列问题.(1)10℃时,100g水中加入20gKNO3达到饱和状态;
根据如图所示的溶解度曲线,回答下列问题.(1)10℃时,100g水中加入20gKNO3达到饱和状态;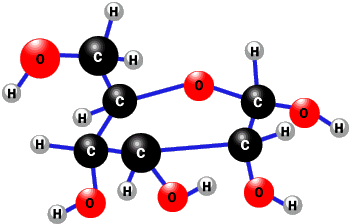 葡萄糖是生活中最常见的一种糖类,其结构如图,下列说法正确的是( )
葡萄糖是生活中最常见的一种糖类,其结构如图,下列说法正确的是( )