题目内容
【题目】金属是人类生活中的常用的材料。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是_。(填“符号”)
(2)铁钉在初中化学实验中多次出现,下图展示了光亮铁钉的一系列变化。![]()
(ⅰ)变化②中,铁钉主要与空气中的_发生反应。
(ⅱ)变化③中除去铁锈的化学方程式为__。
(ⅲ)如果用a、b分别代表光亮的铁钉和无锈铁钉,则它们的质量关系_
A、a<b B、a>b C、a=b D、无法比较
(3)为探究锌、铁、铜三种金属的活动性,以及他们和氢元素的位置关系,小明设计了如下实验,你认为不需要进行的实验是 (填字母序号)。
A.将铁粉放入硫酸锌溶液中
B.将铁粉放入稀硫酸中
C.将铁粉放入硫酸铜溶液中
D.将铜片放入稀硫酸中
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素。图中部分物质略去)。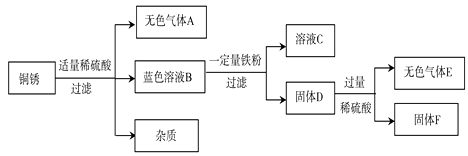
①无色气体A是 , 溶液C中所含的阳离子是 , 固体D中含有的物质是
②在蓝色溶液B中加入铁粉时,发生反应的化学方程式为。
③已知铜锈样品的质量是10g,固体F的质量是3.2g,则铜锈中含Cu2(OH)2CO3的质量分数是。
【答案】
(1)Al
(2)水、氧气,Fe2O3+6HCl=2FeCl3+3H2O,B
(3)C
(4)CO2,Fe2+,Fe,Cu,Fe+ CuCl2= FeCl2+ Cu,55.5%
【解析】(1)地壳中元素的含量用质量分数表达,由多到少的顺序是氧、硅、铝、铁、钙、……。含量最多的金属元素是铝;(2)铁生锈是铁与氧气、水共同作用的结果;铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;据质量守恒定律可知反应前后物质的总质量不变,所以铁锈的质量等于反应前铁的质量与反应的氧气、水的质量和,所以锈蚀后的铁钉的质量大于原铁钉的质量;(3)金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。A.将铁粉放入硫酸锌溶液中,不反应,证明铁在锌后; B.将铁粉放入稀硫酸中,发生反应生成氢气,证明铁在氢前;C.将铁粉放入硫酸铜溶液中,发生反应,溶液由蓝色变成绿色,铁的表面有红色固体析出,证明铁在铜前; D.将铜片放入稀硫酸中,不反应证明铜在氢后,由ABD三组实验即可证明锌>铁>氢>铜,所以C实验不需要进行;(4)碱式碳酸铜和盐酸反应生成氯化铜、水、二氧化碳,氯化铜溶液是蓝色的,所以①A为二氧化碳,B为氯化铜;铁和氯化铜反应生成铜和氯化亚铁,所以溶液C中一定有亚铁离子;固体D中含有的物质是铜;②在氯化铜溶液中加入铁粉时,发生反应的化学方程式为Fe+ CuCl2= FeCl2 + Cu ③ 设Cu2(OH)2CO3的质量分数为X,固体F是铜,即生成的铜的质量是3.2g,10g×X×(128÷228×100%)=3.2g,X=55.5%.
【考点精析】本题主要考查了金属材料的选择依据和金属活动性顺序及其应用的相关知识点,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;在金属活动性顺序里:1、金属的位置越靠前,它的活动性就越强2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)3、位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来.(除K、Ca、Na)才能正确解答此题.

 阅读快车系列答案
阅读快车系列答案