题目内容
【题目】实验室现有某铜锌混合物,为了探究其组成,某同学取 200g 9.8%的稀硫酸进行了如下实验:
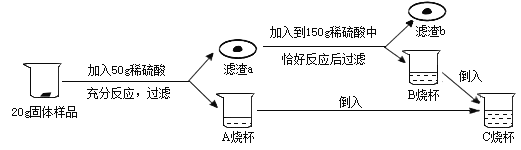
请根据要求回答问题:
(1)请写出实验中发生反应的化学方程式_______________________;
(2)请写出求解第一步参加反应的固体物质质量(![]() )的比例式______________________;
)的比例式______________________;
(3)滤渣 b 的质量为__________________;
(4)原固体中锌的质量分数为______________;
(5)向最终所得溶液中加入 17.4g 的水,则 C 中溶液的溶质质量分数为______________。
【答案】Zn+H2SO4=ZnSO4+H2↑ ![]() 7g 65% 14.0%
7g 65% 14.0%
【解析】
(1)铜锌合金中加入稀硫酸,铜是不活泼金属,所以不与稀硫酸反应,锌是活泼金属与稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑。故填:Zn+H2SO4=ZnSO4+H2↑。
(2)设第一步参加反应的固体物质质量![]() ,加入的稀硫酸溶质的质量为
,加入的稀硫酸溶质的质量为![]() ,根据
,根据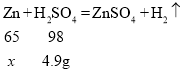 ,
,![]() ,可以求出参加反应的固体物质质量,所以第一步参加反应的固体物质质量(
,可以求出参加反应的固体物质质量,所以第一步参加反应的固体物质质量(![]() )的比例式为
)的比例式为![]() 。故填:
。故填:![]() 。
。
(3)铜锌合金中加入200g9.8%的稀硫酸,恰好完全反应,所得的滤渣b为不参加反应的铜,消耗的硫酸溶质的质量为![]() ,
,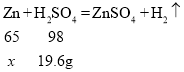 ,
,![]() ,解得
,解得![]() ,即参加反应的锌的质量为13g,所以滤渣b质量为20g-13g=7g。故填:7g。
,即参加反应的锌的质量为13g,所以滤渣b质量为20g-13g=7g。故填:7g。
(4)由(3)中的分析可得,原固体中锌的质量为13g(全部参加反应),所以原固体中锌的质量分数为![]() 。故填:65%。
。故填:65%。
(5)原固体中铜的质量为7g,不参加反应,所以最终所得溶液的质量为![]() ,最终C烧杯中的溶液为锌与稀硫酸恰好反应后生成的硫酸锌溶液,设生成硫酸锌的质量为
,最终C烧杯中的溶液为锌与稀硫酸恰好反应后生成的硫酸锌溶液,设生成硫酸锌的质量为![]() ,
,
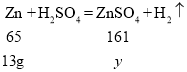 ,
,![]() ,解得
,解得![]() ,向最终所得溶液中加入 17.4g 的水,所以最终烧杯C中的硫酸锌溶液的溶质质量分数为
,向最终所得溶液中加入 17.4g 的水,所以最终烧杯C中的硫酸锌溶液的溶质质量分数为![]() 故填:14.0%。
故填:14.0%。

【题目】研究物质的溶解对于生产、生活有着重要意义。
(1)下表是硝酸钾的部分溶解度数据。
温度(℃) | 20 | 40 | 60 | 80 |
溶解度(g/100g水) | 31.6 | 63.9 | 110 | 169 |
由表中数据可知,硝酸钾的溶解度随温度升高而_______ (填“增大”或“减小”)。60℃时硝酸钾饱和溶液中,溶质与溶液的质量比为_________,能将该饱和溶液转化为不饱和溶液的一种方法是____。
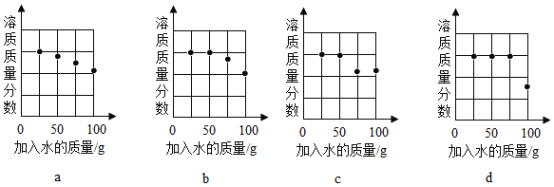
(2)探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。
向硝酸钾中分批加水,充分搅拌,现象如图所示:
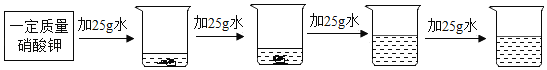
坐标图中,符合实验结果的描点可能是_________(填编号)。