题目内容
镁和氧气反应生成了5g氧化镁,则所消耗的镁和氧气的质量分别为
- A.镁2g、氧气3g
- B.镁3g、氧气2g
- C.镁1g、氧气4g
- D.镁4g、氧气1g
B
分析:根据质量守恒定律,可以得出所消耗的镁和氧气的质量之和等于5g,根据镁和氧的相对质量之比,可以计算出他们所占的份数,进而计算出各自的质量.
解答:镁的相对质量为24,氧的相对质量为16,镁的相对质量:氧的相对质量=24:16=3:2.
根据质量守恒定律可知,所消耗的镁和氧气的质量之和就是生成物氧化镁的质量,
故消耗的镁的质量=5g×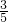 =3g;所消耗的氧气的质量=5g×
=3g;所消耗的氧气的质量=5g× =2g.
=2g.
故选B.
点评:本题主要考查学生运用化学式和化学反应方程式进行计算的能力.
分析:根据质量守恒定律,可以得出所消耗的镁和氧气的质量之和等于5g,根据镁和氧的相对质量之比,可以计算出他们所占的份数,进而计算出各自的质量.
解答:镁的相对质量为24,氧的相对质量为16,镁的相对质量:氧的相对质量=24:16=3:2.
根据质量守恒定律可知,所消耗的镁和氧气的质量之和就是生成物氧化镁的质量,
故消耗的镁的质量=5g×
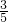 =3g;所消耗的氧气的质量=5g×
=3g;所消耗的氧气的质量=5g× =2g.
=2g.故选B.
点评:本题主要考查学生运用化学式和化学反应方程式进行计算的能力.

练习册系列答案
相关题目
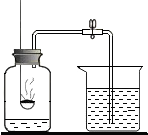 (2013?芜湖县模拟)小明为了测定空气的成分,按下图所示装置做实验:
(2013?芜湖县模拟)小明为了测定空气的成分,按下图所示装置做实验: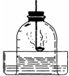 如图是用红磷燃烧,测定空气中氧气含量的实验装置,请根据实验回答下列问题:
如图是用红磷燃烧,测定空气中氧气含量的实验装置,请根据实验回答下列问题: