题目内容
【题目】根据如图提供的几种物质的溶解度曲线,判断下列说法正确的是
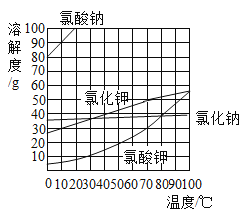
A.氯酸钠溶液降温一定有晶体析出
B.70°C时,8g氯化钠和20g水能形成饱和溶液
C.10°C时,氯化钾饱和溶液中溶质质量分数为30%
D.氯酸钾中混有少量氯化钠,提纯氯酸钾最好用蒸发结晶的方法
【答案】B
【解析】
A、氯酸钠溶液,没有指明温度、溶液是否饱和,所以降温不一定有晶体析出,故选项A不正确;
B、70°C时,氯化钠的溶解度是38g,20g水中最多能溶解7.6g氯化钠,所以8g氯化钠溶于20g水能形成饱和溶液,故选项B正确;
C、10°C时,氯化钾的溶解度是30g,根据饱和溶液中溶质质量分数与溶解度的关系:溶质质量分数=![]() ,10°C时,氯化钾饱和溶液中溶质质量分数=
,10°C时,氯化钾饱和溶液中溶质质量分数=![]() ,故选项C不正确;
,故选项C不正确;
D、氯酸钾的溶解度受温度影响较大,采用冷却热饱和溶液结晶,氯化钠的溶解度受温度影响较小,采用蒸发结晶,氯酸钾中混有少量氯化钠,提纯氯酸钾最好用降温结晶的方法,故选项D不正确。
故选:B。

【题目】以下各图所示是某校兴趣小组测定硝酸钾溶解度的部分操作实况剪。
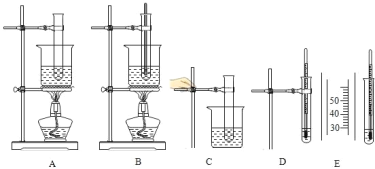
图A 是给试管中水和硝酸钾固体加热;
图B 是在加热过程中进行搅拌;
图 C是待硝酸钾全部溶解后,将试管从烧杯中取出,停止加热;
图 D是在溶液中插入温度计;
图 E是用玻璃棒轻轻摩擦试管内壁,当溶液中刚出现硝酸钾晶体时,记下温度计上所示温度.请根据上述实验内容,回答下列问题:
(1)当试管中硝酸钾的总量达到 15.5g 时,小组同学分别测出的温度为74.9。C,75.0。C,75.3。C,他们将在实验报告中记录的温度是__.他们进行反复实验的目的是__
(2)如表所示为兴趣小组在实验报告中,设计的记录实验数据的表格.请根据表格中已有数据,分析实验时,试管中盛有水的体积为__,并将表中空格内的相应溶解度填写完整.
试管中硝酸钾的总量/g | 5 | 6.5 | 8 | 10 | 12.5 |
开始析出晶体时的温度t/。C | 32.8 | 39.6 | 45.8 | 54.7 | 64.9 |
溶解度/g | 50 | _ | _ | _ | _ |
【题目】如图甲、乙、丙、丁是初中化学中常见的四种物质。“→”表示物质间的转化关系 (部分反应物、生成物及反应条件已省略)。不能实现如图转化的是( )
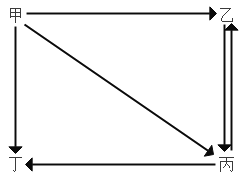
选项 | A | B | C | D | |
物质 | 甲 | CuSO4 | Na2CO3 | C | O2 |
乙 | Cu(OH)2 | CaCO3 | CO2 | CO | |
丙 | CuCl2 | CO2 | CO | CO2 | |
丁 | Cu(NO3)2 | NaOH | Cu | H2O | |
A.AB.BC.CD.D
【题目】过氧化钠(Na2O2)可用作呼吸面具的供氧剂。实验室有一瓶放置较长时间的过氧化钠样品,某研究小组对其成分和性质进行了如下探究。
[查阅资料]过氧化钠能与空气中水和二氧化碳反应生成氧气:
2Na2O2 +2H2O=4NaOH+O2↑
2Na2O2+2CO2 =2Na2CO3+O2
[提出问题]过氧化钠是否变质?
[提出猜想]猜想一:________;
猜想二:过氧化钠部分变质;
猜想三:过氧化钠全部变质。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
①取部分固体于试管中,加入适量水,在试管口插入带火星木条 | 固体溶解,有气泡产生_______ | 猜想三不成立 |
②取少量①中溶液于另一试管中,滴加足量_______,振荡 | 有气泡生成 | 猜想二成立 |
[反思评价]
(1)请写出实验②中产生气泡的化学反应方程式_________;
(2)小华同学想通过实验,进一步确定部分变质的过氧化钠中是否含有氢氧化钠,于是进行了如下的实验操作:取少量①中溶液于试管中,加入足量的氯化钙溶液,有白色沉淀生成,静置,向上层清液中加入少量________,溶液变红,证明部分变质的过氧化钠中含有氢氧化钠。
(3)小明同学认为,小华同学的实验仍无法确定原固体样品中是否含有氢氧化钠,理由是________。
【题目】普通干电池在生活中的用途很广。
(1)普通干电池照明时化学能转化为____。
(2)目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术。如图为普通电池(锌锰电池)示意图,请你根据图示将回收的废旧电池进行分离,可以得到的金属单质有(用化学式表示,下同)____,氧化物有___,盐有____,有机物有__(写名称)。
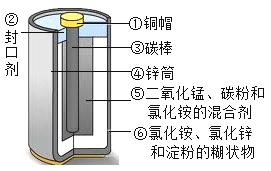
(3)小明同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子。设计了如下实验步骤,请你帮他完成。
实验步骤 | 实验现象 | 结论或解释 |
①剥开干电池,取出碳棒周围的黑色粉末 | ||
②溶解、___(填操作名称)、洗涤 | 得到黑色粉末和无色澄清液体 | 黑色粉末的成分为__。 |
③对黑色粉末进行__ | 得到纯净的MnO2固体 | |
④检验第②步中得到的无色澄清液体中是否含铵根离子的方法是:_____ | _____ | 化学方程式为:______ |
(4)对分离回收的铜帽净化处理,放入硝酸银溶液中,一段时间以后,可观察到的现象是__,反应的化学方程式是_____,其基本反应类型为___反应。