题目内容
【题目】某校九年级“我们爱化学”活动小组的同学,在探究碱的化学性质时,完成了如图所示的A、B两个实验。请你回答下列问题:


(1)A实验中酚酞的作用是_____,所发生的化学反应方程式为_____。
(2)B实验中可观察到的现象是_____;Na2CO3的俗名是_____。
(3)实验后,将两支试管中的废液都倒入废液杯C中,发现混合废液浑浊并显红色。
(分析思考)同学们经过思考一致认为,混合废液显红色是B实验后试管中的溶质与A实验后试管中的酚酞反应的结果。
(提出问题)B实验后试管中的溶质是什么?
(作出猜想)猜想一:试管中的溶质是NaOH;猜想二:试管中的溶质是_____;猜想三:试管中的溶质是Ca(OH)2和NaOH。
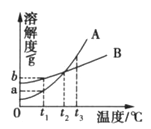
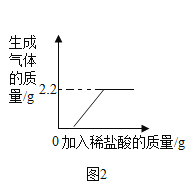
(实验验证)华雪同学利用废液杯C中的混合废液来确定B实验后试管中的溶质:将一定质量的废液过滤,取10g滤液并向其中逐滴加入质量分数为7.3%的稀盐酸,当加入稀盐酸的质量为20g时反应完全,继续加入稀盐酸,气体的质量不再增加,根据反应现象得到如上最右图所示的图像。
(实验结论)定性结论:分析图像得出:猜想二是正确的,产生的气体是_____(填化学式);猜想一和猜想三是错误的,原因是_____。
定量结论:10g废液中含有Na2CO3_____g;NaOH_____g。
(拓展提升)①请另外设计一个实验,定性证明上述猜想二是正确的:_____。
②测定C烧杯内上层清液的pH的方法是_____。
【答案】帮助判断稀盐酸和氢氧化钠是否发生反应 NaOH+HCl=NaCl+H2O 澄清石灰水变浑浊 纯碱(或苏打) Na2CO3和NaOH CO2 稀盐酸和Ca(OH)2、NaOH反应不会有气体生成(合理即可) 1.06 0.8 向废液中加入足量的氯化钙 (或氯化钡)溶液充分反应后产生白色沉淀,向过滤后的滤液中加入无色酚酞试液,呈红色,证明猜想二正确 用洁净干燥的玻璃棒蘸取少量上层清液滴在pH试纸上,再与标准比色卡比较,读出pH
【解析】
根据中和反应原理、极限假设法以及化学反应图象和化学反应原理解答。
(1)由于稀盐酸和氢氧化钠反应没有任何现象,要借助酚酞帮助判断稀盐酸和氢氧化钠是否发生反应,稀盐酸和氢氧化钠发生中和反应生成氯化钠和水,故填:帮助判断稀盐酸和氢氧化钠是否发生反应;NaOH+HCl=NaCl+H2O。
(2)B实验中碳酸钠和氢氧化钙发生反应生成碳酸钙和水,所以看到的实验现象是澄清石灰水变浑浊,Na2CO3的俗称是纯碱(或苏打),故填:澄清石灰水变浑浊;纯碱(或苏打)。
(3)[作出猜想]
碳酸钠溶液与氢氧化钙溶液恰好完全反应时,溶质只有NaOH,碳酸钠过量时,溶质为Na2CO3和NaOH,氢氧化钙溶液过量时,溶质为Ca(OH)2和NaOH,所以猜想二为Na2CO3和NaOH,故填:Na2CO3和NaOH。
[实验结论]
根据题意和分析图象得出,稀盐酸和Ca(OH)2、NaOH反应不会有气体生成,所以猜想一和猜想三是错误的,猜想二是正确的,产生的气体是CO2;从图中可以看出生成CO2的质量是0.44g,设碳酸钠的质量为x,与碳酸钠反应的HCl的质量为y
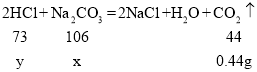
![]()
x=1.06g
![]()
y=0.73g
加入20g 7.3%的稀盐酸中含有HCl的质量为20g×7.3%=1.46g,则与NaOH反应的HCl的质量为1.46g-0.73g=0.73g,设NaOH的质量为z
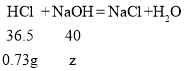
![]()
z=0.8g
由于混合物废液中没有Ca(OH)2,所以Ca(OH)2的质量为0g。
故填:CO2;稀盐酸和Ca(OH)2、NaOH反应不会有气体生成(合理即可);1.06;0.8。
[拓展提升]
①由于Na2CO3溶液可以与氯化钙溶液或氯化钡溶液反应生成白色沉淀,加入足量的氯化钙溶液或氯化钡溶液可以将Na2CO3反应完,氯化钙溶液或氯化钡溶液显中性,如果有氢氧化钠,则混合容易仍为红色。故填:向废液中加入足量的氯化钙 (或氯化钡)溶液充分反应后产生白色沉淀,向过滤后的滤液中加入无色酚酞试液,呈红色,证明猜想二正确。
②测定C烧杯内上层清液的pH的方法是:用洁净干燥的玻璃棒蘸取少量上层清液滴在pH试纸上,再与标准比色卡比较,读出pH,故填:用洁净干燥的玻璃棒蘸取少量上层清液滴在pH试纸上,再与标准比色卡比较,读出pH。