题目内容
【题目】A、B…H八种物质,有如图所示关系:其中A是一种白色固体;B是黑色固体,在①反应中B作催化剂;D能使带火星的木条复燃;E是一种黑色固体,在D中燃烧产生使澄清石灰水变浑浊的气体F;G是淡黄色固体,在D中燃烧发出明亮的蓝紫色火焰,生成气体H。试推断:

(1)写出下列物质的名称或符号:B________;H__________。
(2)写出D和E反应的文字或符号表达式: ____________________。
(3)写出A和B加热反应的文字或符号表达式____________________。
【答案】二氧化锰或MnO2 二氧化硫或SO2 碳+氧气![]() 二氧化碳或C+O2
二氧化碳或C+O2![]() CO2 氯酸钾
CO2 氯酸钾![]() 氯化钾+氧气或KClO3
氯化钾+氧气或KClO3![]() KCl+O2
KCl+O2
【解析】
A、B…H八种物质,D能使带火星的木条复燃,所以D是氧气,A是一种白色固体,B是黑色固体,在①反应中B作催化剂,A、B加热生成氧气,氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,所以A是氯酸钾,B是二氧化锰,C是氯化钾,E是一种黑色固体,在D中燃烧产生使澄清石灰水变浑浊的气体F,碳和氧气在点燃的条件下生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以E是碳,F是二氧化碳,G是淡黄色固体,在D中燃烧发出明亮的蓝紫色火焰,生成气体H,硫在氧气中燃烧发出明亮的蓝紫色火焰,所以G是硫,H是二氧化硫,经过验证,推导正确。
(1)B是二氧化锰或MnO2,H是二氧化硫或SO2;
(2)D和E的反应是碳和氧气在点燃的条件下生成二氧化碳,表达式为:碳+氧气![]() 二氧化碳或C+O2
二氧化碳或C+O2![]() CO2,
CO2,
(3)A和B加热的反应是氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,表达式为:氯酸钾![]() 氯化钾+氧气或KClO3
氯化钾+氧气或KClO3![]() KCl+O2。
KCl+O2。

【题目】某研究小组在学习氧气的化学性质时发现:石灰石大多数可燃物在空气中就能燃烧,而铁丝在空气中不能燃烧,在氧气中可以剧烈燃烧。该小组同学进行了下列探究。
(作出猜想)由以上事实可以作出以下猜想:
猜想一:可燃物燃烧的剧烈程度可能与氧气的浓度有关。
猜想二:可燃物燃烧的剧烈程度可能与________________________有关。
(提出问题)可燃物的燃烧与氧气的浓度的大小有什么关系?
(查阅资料)
(1)在规定的条件下,物质在氧气、氮气混合气流中,维持稳定燃烧所需的最低氧气浓度(以氧气所占的体积百分数表示)叫氧指数。氧指数高表示材料不易燃,氧指数低表示材料容易燃烧。一般认为:氧指数![]() 属易燃材料,
属易燃材料,![]() 氧指数
氧指数![]() 属可燃材料,氧指数
属可燃材料,氧指数![]() 属难燃材料。下面是一些常见物质的氧指数。
属难燃材料。下面是一些常见物质的氧指数。
可燃物 | 红磷 | 木炭 | 硫 | 蜡烛 | 铁丝 |
氧指数 | 0.5% | 4% | 4.5% | 5%~6% | 60% |
(2)氢氧化钠溶液和澄清石灰水都能吸收二氧化碳,但氢氧化钠溶液吸收二氧化碳的能力更好。
(设计并实验)
(1)写出铁丝在氧气中燃烧的化学方程式:_______________。
(2)由上表可知铁丝是________(填“易燃”“可燃”或“难燃”)材料。
(3)在测定空气中氧气含量的实验中,我们通常选择红磷燃烧而不选择木炭或硫的原因是_______________。
(反思与评价)
(4)如果一定要用木炭代替红磷做这个实验,只要对实验稍作改进即可,需要对实验改进的是________________;理由是_____________________。
(5)即使这样改进,根据上表数据可知:仍然没有用红磷燃烧好,原因是____________。
【题目】小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题,他设计并完成了下表所示的探究实验。
实验操作 | 实验现象 | 实验结论或总结 | ||
各步骤结论 | 总结 | |||
实验一 | 加热氯酸钾至熔化,伸入带火星小木条 | 木条复燃 | 氯酸钾受热分解能产生氧气,但_________ | 二氧化锰是氯酸钾受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星小木条 | 木条不复燃 | 二氧化锰受热不产生氧气 | |
实验三 | ____________________, 伸入带火星的小木条 | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解速度,文字表达式为____________ | |
(1)在小明的探究实验中,“实验一”和“实验二”起的作用是_______________;
(2)仅由上述实验______________(填“能”或“不能”)完全得出表内总结,你的理由是__________________________。
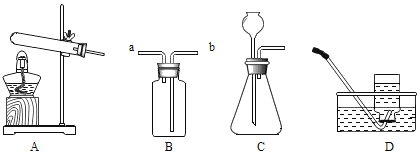
【题目】某化学兴趣小组利用下列装置进行制取氧气的实验,结合所学的内容回答下列问题。
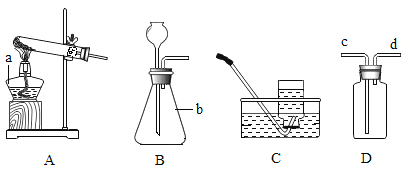
(1)①图中a、b仪器的名称,a_____,b_____;
②用高锰酸钾固体制氧气,该反应的符号表达式是_____,属于_____(填基本反应类型),选用的制取装置是_____(填下字母),若用D装置进行收集氧气,进行验满的操作是_____。
(2)加热高锰酸钾固体。先后用两种方法各收集三瓶氧气,分别测定了收集到的氧气浓度。数据见表。
收集方法 | 排水法 | 向上排空气法 | ||||
氧气浓度% | 80.3 | 90.0 | 89.8 | 79.9 | 79.6 | 79.7 |
氧气平均浓度% | 86.7 | 79.7 | ||||
①用排水法收集氧气时,以观察到_____为氧气集满的标准。
②用排水法收集时第一组数据明显偏低, 若能等到_____开始收集则可避免这种情况。以上两种方法中收集到的氧气更纯净的是_____。
③用向上排空气法收集到的氧气浓度为80%左右的原因有_____(填序号)。
A 氧气的密度略大于空气的密度,有部分空气无法排干净
B 当观察到带火星木条复燃时,集气瓶内还有空气
C 当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
【题目】某兴趣小组同学对实验室制取氧气的条件进行如下探究。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
①3.0gKClO3与1.0gMnO2均匀混合加热
②将Xg KClO3与1.0g氧化铜均匀混合加热,在相同温度下,比较两组实验产生O2的快慢。
①中反应的符号表达式是___________;②中X的值为________。
(2)乙探究了影响双氧水分解速度的某种因素,实验数据记录如表:
双氧水的质量 | 双氧水的浓度 | 二氧化锰的质量 | 相同时间内产生氧气的体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2的装置是_________(填序号)。
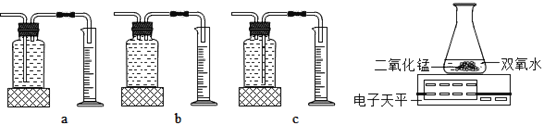
实验结论:在相同条件下_________________,双氧水分解得快。丙用装置电子天平进行实验,通过比较_____________________也能达到实验目的。