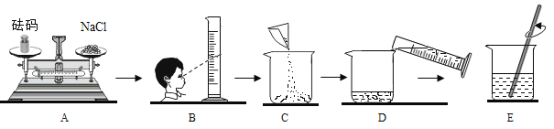
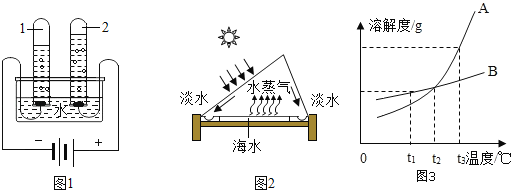
题目内容
【题目】A~H是初中化学常见物质,已知B为黑色固体,D为红色固体单质,F为红色固体,他们的转化关系如图所示。请回答下列题:
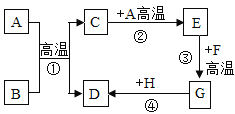
(1)物质B、E的化学式分别为、_____________。
(2)反应③的化学方程式分别为________,反应③在实际生产中的应用是________。
(3)反应①、③的基本反应类型是否相同?_____________(填“相同”或“不同”)。
【答案】CuO、CO Fe2O3+3CO![]() 2Fe+3CO2 冶炼金属 不相同
2Fe+3CO2 冶炼金属 不相同
【解析】
B为黑色固体,D为红色固体单质,则B可能为氧化铜,D可能为铜,A具有还原性,和氧化铜反应产生的C能够和A反应产生E,因此A是碳,生成的C为二氧化碳,二氧化碳能与碳反应生成一氧化碳,E为一氧化碳;F为红色固体,能与一氧化碳反应,一氧化碳和氧化铁反应生成铁和二氧化碳,则F为氧化铁,生成的G为铁,铁能与铜盐反应生成铜,H可能硫酸铜,代入验证,推理正确。
由分析可知(1)物质B、E的化学式分别为:CuO、CO;
(2)反应③是一氧化碳与氧化铁在高温下生成二氧化碳和铁,反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2,反应③在实际生产中的应用是铁矿石炼铁;
2Fe+3CO2,反应③在实际生产中的应用是铁矿石炼铁;
(3)反应①是碳和氧化铜在高温的条件下反应生成铜和二氧化碳,该反应是单质和化合物生成单质和化合物的反应,属于置换反应;反应③是一氧化碳与氧化铁的反应不是置换反应,故反应类型不同。

【题目】化学就在我们身边,请用所学的化学知识填空。
(1)从H、O、C、Cl、Ca五种元素中,选择适当的元素组成符合下列要求的物质,并用化学式填空(每空只填一种物质)。
①相对分子质量最小的氧化物是_______;
②农业上用来降低土壤酸性的_________;
③可用于金属表面除锈的是____________;
④厨房用的酸性调味品是____________;
⑤最简单的有机物是________。
(2)以下是日常生活中常用各种清洗剂
名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 活氧彩漂 | 污渍爆炸盐 |
产品样式 |
|
|
|
|
|
有效成分或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过氧化氢 | 过碳酸钠 |
①使用洗涤灵清洗餐具上的油污,这是因为它具有__________功能。
②清除以下物质,可使用炉具清洁剂的是______________(填字母序号)。
a.铁锈 b.油污 c.水垢
③“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,产生能使澄清石灰水变浑浊的气体,此反应体现了如图中______________(选填①②③④)性质关系。

④将洁厕灵加入滴有酚酞的炉具清洁剂中,若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)_____________________。
【题目】碳酸镁水合物是制备镁产品的中间体。
(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图:
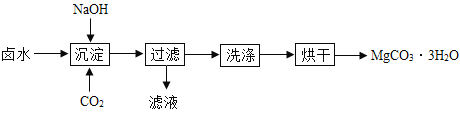
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2___。
(2)沉淀过程的pH随时间的变化如图所示,沉淀过程的操作为____(填标号)。
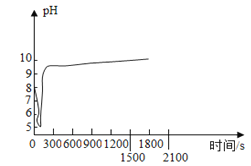
a 向卤水中滴加NaOH溶液,同时通入CO2
b 向NaOH溶液中滴加卤水,同时通入CO2
c 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图所示,不同温度下所得到沉淀产物如下表所示。
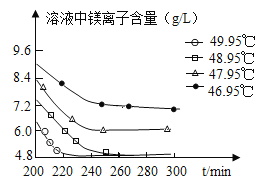
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为____℃,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
(测定MgCO33H2O的纯度)
(查阅资料)
1.碱石灰是CaO与NaOH的固体混合物。
2.MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O。
3.Mg5(OH)2(CO3)44H2O也可以表示为Mg(OH)24MgCO34H2O,其相对分子质量为466,能与硫酸反应生成CO2。
4.Ba(OH)2能溶于水
(实验步骤)
利用如下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度。
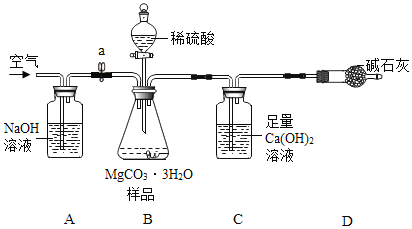
依据实验过程回答下列问题:
(1)A中NaOH溶液的作用是________。
(2)C装置中反应生成CaCO3的化学方程式为_____;D中碱石灰的作用为___。
(3)下列各项措施中,不能提高测定准确度的是____(填标号)。
a 在加入硫酸之前,应排净装置内的CO2气体
b 为了缩短实验时间,快速滴加硫酸
c 在A~B之间增添盛有浓硫酸的洗气装置
d 在C装置左侧导管末端增添多孔球泡
(4)小明认为应将C装置中澄清石灰水换成Ba(OH)2溶液,理由一:___,使CO2被吸收的更完全;理由二: BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO
(5)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g。请计算样品中MgCO33H2O的纯度(写出计算过程)____。
(6)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则样品中MgCO33H2O的纯度____(填“偏大”“不变”或“偏小”)。
【题目】黄铜是铜和锌的合金![]() ,为了测定黄铜样品中锌的质量分数,现将80g稀硫酸平均分成4份,分别与一定质量的黄铜样品进行实验,每次充分反应后,测定生成氢气的质量数据如下表:
,为了测定黄铜样品中锌的质量分数,现将80g稀硫酸平均分成4份,分别与一定质量的黄铜样品进行实验,每次充分反应后,测定生成氢气的质量数据如下表:
实验次数 | 一 | 二 | 三 | 四 |
黄铜样品质量/g | 1 | 2 | 3 | 4 |
生成氢气质量/g | 0.02 | 0.04 | 0.05 | M |
(1)从第_____次实验开始黄铜样品有剩余;
(2)M=_____;
(3)黄铜样品中锌的质量分数?_____(写出具体的计算过程![]()