题目内容
【题目】小明为了测定某钙片中碳酸钙的质量分数,用如图装置进行如下实验:
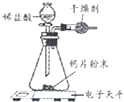
①取研碎后的钙片4克,导入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐酸,置于电子天平上测出装置总质量.
②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量.
③整理相关数据如表所示,计算出钙片中碳酸钙的质量分数.
反应前总质量(克) | 275.58 |
反应后总质量(克) | 274.92 |
反应前后总质量差(克) | 0.66 |
容器内气体质量差(克) | m |
(1)该实验中,对装置中的固态干燥剂的性质有何要求?
(2)反应前容器内是空气(密度为ρ1),反应后全部是二氧化碳(密度为ρ2),则反应前后容器(容积为V)内的气体质量差为m为 .(用字母表示,反应物的体积忽略不计)
(3)小明查阅有关数据后,计算出反应前后容器内的气体质量差m为0.22克,结合表中数据,计算该钙片中碳酸钙的质量分数.(CaCO3+2HCl=CaCl2+H2O+CO2↑).钙片中的其它成分不与盐酸反应.
【答案】(1)能吸收水但不吸收二氧化碳;
(2)(ρ2﹣ρ1)V;(3)该钙片中碳酸钙的质量分数为50%.
【解析】(1)该实验中,装置中的固态干燥剂要干燥的气体是二氧化碳,应具备的性质是:能吸收水但不吸收二氧化碳;
(2)反应前容器内是空气(密度为ρ1),反应后全部是二氧化碳(密度为ρ2),则反应前后容器(容积为V)内的气体质量差为m为:(ρ2﹣ρ1)V;
(3)解:设钙片中碳酸钙的质量为x
反应后生成的二氧化碳的质量为:0.66g+0.22g=0.88g
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.88g
![]() 解得:x=2g
解得:x=2g
该钙片中碳酸钙的质量分数为:![]() =50%
=50%
故答案为:(1)能吸收水但不吸收二氧化碳;
(2)(ρ2﹣ρ1)V;(3)该钙片中碳酸钙的质量分数为50%.

 优等生题库系列答案
优等生题库系列答案