题目内容
【题目】生铁是铁的合金。化学兴趣小组的同学为测定某生铁样品中铁的质量分数。进行如下实验:称取生铁样品5.8 g放入烧杯中,逐滴加入稀硫酸,所加稀硫酸的质量与放出气体的质量关系如下图所示(生铁样品中的杂质不与稀硫酸反应,也不溶于水)。回答下列问题:

(1)当滴加稀硫酸质量为_________时,恰好完全反应,此时产生气体质量为_________。
(2)计算生铁样品中铁的质量分数(结果保留0.1%,下同)。
(3)计算所用稀硫酸中溶质的质量分数。
【答案】(1)50g;(2)96.6%;(3)19.6%
【解析】从图上能看出,稀硫酸的质量是50 g时,气体的质量不再增加,所以反应恰好完成,此时生成的氢气的质量是0.2 g。
设铁的质量为x,50 g稀硫酸中溶质的质量为y
Fe+H2SO4===FeSO4+H2↑
56 98 2
x y 0.2 g
![]()
![]()
x=5.6 g y=9.8g
![]() =96.6%
=96.6% ![]()
答:生铁样品中铁的质量分数为96.6%,所用稀硫酸的溶质质量分数为19.6%。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】小明为了测定某钙片中碳酸钙的质量分数,用如图装置进行如下实验:
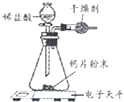
①取研碎后的钙片4克,导入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐酸,置于电子天平上测出装置总质量.
②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量.
③整理相关数据如表所示,计算出钙片中碳酸钙的质量分数.
反应前总质量(克) | 275.58 |
反应后总质量(克) | 274.92 |
反应前后总质量差(克) | 0.66 |
容器内气体质量差(克) | m |
(1)该实验中,对装置中的固态干燥剂的性质有何要求?
(2)反应前容器内是空气(密度为ρ1),反应后全部是二氧化碳(密度为ρ2),则反应前后容器(容积为V)内的气体质量差为m为 .(用字母表示,反应物的体积忽略不计)
(3)小明查阅有关数据后,计算出反应前后容器内的气体质量差m为0.22克,结合表中数据,计算该钙片中碳酸钙的质量分数.(CaCO3+2HCl=CaCl2+H2O+CO2↑).钙片中的其它成分不与盐酸反应.