题目内容
【题目】为了测定混有杂质的石灰石样品中碳酸钙的质量分数,取20g样品高温加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:
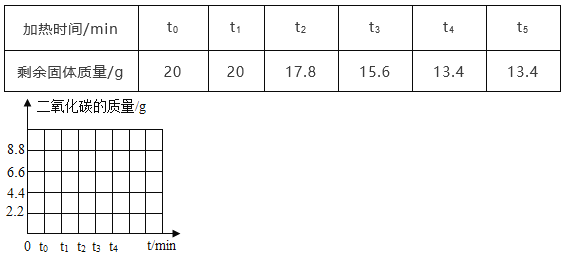
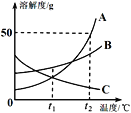
(1)请在坐标图中,画出锻烧时生成气体的质量(m)反应时间(t)变化的曲线________
(2)该反应化学方程式为: ________。
(3)在t0至t1时间段 , 固体质量不变的原因可能是__________。
(4)通过计算求样品中碳酸钙的质量分数________。(写出计算过程)
【答案】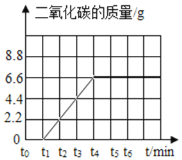 CaCO3
CaCO3![]() CaO+CO2↑ 刚刚开始加热,尚未达到石灰石分解的温度 75%
CaO+CO2↑ 刚刚开始加热,尚未达到石灰石分解的温度 75%
【解析】
(1)根据质量守恒定律可得,生成的二氧化碳的质量=20g-13.4g=6.6g;
煅烧时生成气体的质量(m气)应时间(t)变化的曲线如图所示: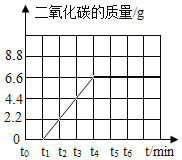
(2)碳酸钙高温条件下反应生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(3)在t0至t1时间段,固体质量不变的原因是刚刚开始加热,尚未达到石灰石分解的温度;
(4)设:碳酸钙的质量分数为x。
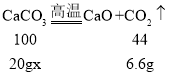
![]() x=75%。
x=75%。
答:样品中碳酸钙的质量分数为75%。

【题目】某同学将光亮的镁条放入滴有酚酞的 NaHCO3 饱和溶液中,产生大量气泡和白色固体,溶液红色加深。点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。过滤,将白色固体洗净、干燥。
(1)溶液红色加深,则反应后溶液的碱性_____(填“增强”、“不变”或“减弱”)。
(2)则该气体为_____(写化学式)。
(3)为确定白色固体的成分,该同学进行了如下的探究。
(查阅资料)Mg(HCO3)2 能溶于水;MgCO3、Mg(OH)2 加热易分解,都生成两种氧化物。
(提出猜测)白色固体是:Ⅰ.MgCO3;Ⅱ__________;Ⅲ.MgCO3和 Mg(OH)2。
(进行实验)
操作 | 现象 | 结论 |
①取白色固体于试管中,加入足量的稀盐酸 | 产生气泡,固体溶解 | 白色固体中一定含有_________(写名称) |
②称取干燥的白色固体 22.6 g 放在石棉网上充分加热 | 固体质量减少 |
(结论分析)
(4)据上述实验现象,小明认为猜想Ⅰ正确。但有同学认为小明的判断不严谨,因为猜想____也有相同现象。
(5)步骤①一定发生反应的化学方程式为:_____________________________。
(6)如要要确定白色固体的组成,还需要补充的操作是_____________________,再通过_______得出结论。