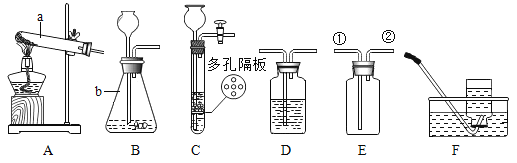
题目内容
【题目】如图是几种物质的溶解度曲线,请根据图示回答:
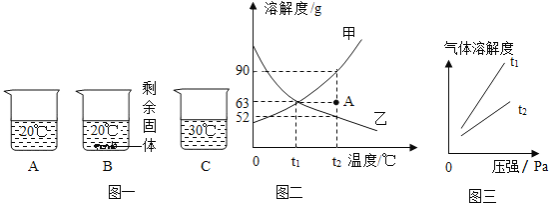
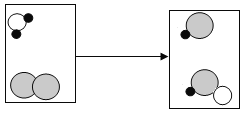
(1)向装有等量水的A、B、C烧杯中分别加入10g、25g、25g NaNO3固体, 充分溶解后,现象如图一所示。烧杯中的溶液一定属于饱和溶液的是____________(填序号);
(2)图二能表示NaNO3溶解度曲线的是_____________(填“甲”或“乙”);
(3)由图二分析,若分别将甲、乙的饱和溶液从t2°C降温到t1°C,对所得溶液的叙述正确的___________(填序号)。
A甲、乙都是饱和溶液
B所含溶剂质量:甲<乙
C溶液质量:甲<乙
D溶质质量分数:甲>乙
(4)如图二所示,现有一杯t2°C时A点的甲溶液,100g水中溶有63g甲,若将其变成饱和溶液,可以增加溶质甲_____________g,或者蒸发掉水____________g,或者还可以将温度_______________。
(5)由图二分析,下列说法正确的是_______________。
A将甲物质的不饱和溶液变为饱和溶液,其溶质的质量分数一定变大
B将t1°C时乙溶液升温到t2°C,其溶液的质量一定减小
C配制一定溶质质量分数的甲物质溶液,若量取水时俯视读数,其它操作均正确,则配制的甲溶液中溶质的质量分数将偏高
(6)某同学在实验室用固体甲和蒸馏水配制50g质量分数为6%的甲溶液时(固体甲全部溶解),涉及以下实验步骤:①溶解②称量和量取③计算④装入试剂瓶贴好标签,配制上述溶液正确的实验步骤顺序是_______(填序号)
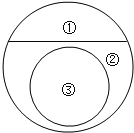
(7)如图三所示,气体的溶解度也有一定规律,如:在t1°C和t2°C这两个不同温度下,氧气的溶解度随压强而变化的情况,若t1°C对应的温度为40°C,则t2°C对应的温度____________(填字母序号)
A小于40°C
B大于40°C
C等于40°C
D无法确定
【答案】B 甲 D 27 30 t1°C C ③②①④ B
【解析】
(1)由图一可知,烧杯B中固体有剩余,则其中的溶液一定是饱和溶液,烧杯A与C中的固体没有剩余,无法判断溶液是否饱和,故填B。
(2)由图一可知,烧杯BC中的等质量的水中分别加入25g NaNO3固体充分溶解,20°C时固体有剩余,30°C时固体全部溶解,说明NaNO3固体的溶解度随温度升高而增大,图二中溶解度曲线甲代表物质的溶解度随温度升高而增大,即能表示NaNO3溶解度曲线的是甲,故填甲。
(3)A 将甲、乙的饱和溶液从t2°C降温到t1°C时,甲的溶解度随温度降低而减小,溶液仍为饱和溶液,而乙的溶解度随温度降低而增大,则乙的饱和溶液变为不饱和溶液,选项错误;
B 题目中没有给出两种溶液的质量,所以无法确定两种溶液中的溶剂质量的大小,选项错误;
C 题目中没有给出两种溶液的质量,温度从t2°C降温到t1°C后无法确定两种溶液的质量的大小,选项错误;
D 当温度从t2°C降温到t1°C,乙的溶解度增大,得到t1°C时乙的不饱和溶液,且溶液的溶质质量分数不变,由图可知,t2°C时乙的溶解度小于t1°C甲的溶解度,所以当温度从t2°C降温到t1°C时,得到的两种溶液的溶质质量分数的关系为:甲>乙,选项正确,故选D。
(4)由图可知,t2°C时甲的溶解度为90g,此时如果100g水中溶有63g甲,若将其变成饱和溶液,需要加入溶质甲的质量为90g63g=27g,故填27;
由图可知,t2°C时甲的溶解度为90g,则63g甲形成饱和溶液需要水的质量为63g×![]() =70g,所以溶液变为饱和溶液需要蒸发水的质量为100g70g=30g,故填30;
=70g,所以溶液变为饱和溶液需要蒸发水的质量为100g70g=30g,故填30;
由图可知,t1°C时甲的溶解度为63g,即t1°C63g甲与100g水能形成饱和溶液,所以改变温度得到饱和溶液可以把溶液降温至t1°C,故填降温至t1°C。
(5)A 甲的溶解度随温度降低而减小,降温可将甲的不饱和溶液变为饱和溶液,此时溶液中的溶质与溶剂的质量不变,则溶质质量分数不变,选项错误;
B 由图可知,乙的溶解度随温度升高而减小,如果乙的不饱和溶液从t1°C时升温到t2°C时可能接近饱和,则乙溶液的溶质质量分数不变,选项错误;
C 配制一定溶质质量分数的甲物质溶液,量取水时俯视读数,则量取的水的实际体积小于需要的水的体积,即所配溶液中的溶剂的量不足,所以配制的溶液的溶质质量分数会偏大,选项正确,故填C。
(6)配制一定溶质质量分数的溶液时,其操作步骤为:计算、称取和量取、溶解、装入试剂瓶贴好标签,故填③②①④。
(7)气体的溶解度随温度升高而减小,随压强增加而增大,由图可知,t2°C时氧气的溶解度小于t1°C时氧气的溶解度,则t2°C高于t1°C,即t2°C对应的温度大于40°C,故填B。

 阶梯计算系列答案
阶梯计算系列答案