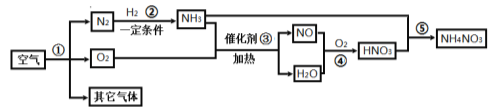
题目内容
【题目】(8分)人教版九年级化学上册教材图3-12部分原子的结构示意图如下:
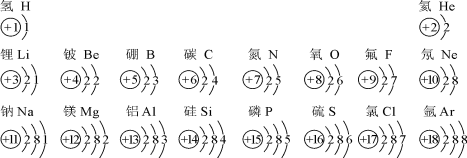
请回答:
(1)氧元素属于非金属元素,其原因是 ;
(2)同一周期(横行)的原子结构示意图具有共同的特点是 (任写一点)。
(3)表中可由原子直接构成的气态物质有 (作写一种);12号和17号元素组成的化合物的化学式为 ,其中构成该物质的阳离子的符号是 。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素的原子具有相似化学性质的是 (填标号)。
a. He和Na b. Be和Mg c. Al和Si d. F和Cl
(5)一般地说,电子层数相同的原子,原子的半径随原子序数的递增而减小(稀有气体除外);最外层电子数相同的原子,原子的半径随电子层数的增加而增大。
请比较:氮原子半径 (填“>”或“<”,后同)磷原子半径;钠原子半径 铝原子半径。
【答案】(1)氧原子最外层电子数大于4
(2)各原子的电子层数相同
(3)氦气(或氖气、氩气)(或其化学式) MgCl2 Mg2+
(4)bd (有错或漏不得分)
(5)< >
【解析】
试题分析:(1)一般最外层电子数大于等于4的元素为非金属元素,根据氧原子的原子结构示意图可知,它的最外层电子数为6,大于4,故氧元素属于非金属元素。
(2)同一周期(横行)的原子结构示意图具有共同的特点是:各原子的电子层数相同。
(3)稀有气体是由原子直接构成的物质,如氦气(或氖气、氩气);12号元素为镁,17号元素为氯,二者形成的化合物为:MgCl2,构成该物质的阳离子的符号是:Mg2+
(4)由图可知,Be和Mg处于同一族,F和Cl处于同一族,故具有相似的化学性质。故选bd。
(5)氮原子和磷原子最外层电子数相同,磷原子的电子层数较多,故原子半径较大,即氮原子半径<磷原子半径;钠原子和铝原子电子层数相同,铝原子的原子序数较大,故半径较小,即钠原子半径>铝原子半径。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】(12分)定量研究对于化学科学发展有重大作用,因此我们应该掌握好有关质量守恒定律的相关知识。
(1)下图A、B、C三个实验用于验证质量守恒定律,其中不能达到实验目的的是 (选填序号),理由是 。

(2)自然界中绿色植物光合作用可用下式表示:CO2 + H2O![]() 淀粉 + O2
淀粉 + O2
① 分析化学反应前后元素种类可知:淀粉中一定含有的元素是_ ___(填元素符号),可能含有的元素是__ _ _(填名称)。
在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | A | B | C | D |
反应前质量/g | 2 | 24.5 | 4 | 8 |
反应后质量/g | 16.9 | 0 | 13.6 | X |
表中X=________,在反应中D这种物质可能起_ __ _ 作用。容器内发生反应的基本类型是________。
(3)某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
①请写出镁条与氧气反应的文字表达式_ __ _。
②小明发现燃烧后产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。小红对此提出了异议,小红的理由是_ __ _。
(4)右图是一个具有刻度和可滑动的活塞的玻璃容器,其中有空气和足量的白磷,将它放在盛有沸水的烧杯上方,进行实验。请回答下列问题:
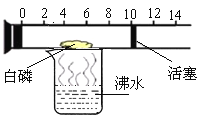
①玻璃容器中发生反应的文字表达式为: 。
实验目的 | 实验现象 | 实验结论 |
测定空气中 的体积分数 | 白磷着火燃烧,活塞先右移,后左移,最后停在刻度约为 (填整数)的位置上。 | 空气的成分按体积计算,该气体约占空气体积的21% |
②填写表格中的空白: