题目内容
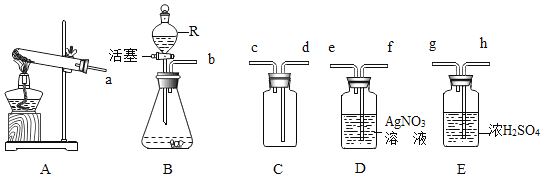
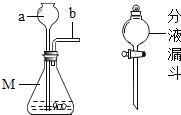
【题目】普通酸性锌锰干电池的结构如下图所示.
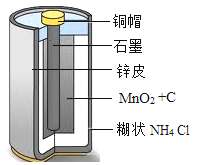

为回收二氧化锰并探究其性质,对废旧的酸性锌锰干电池进行了分拆,流程如下:
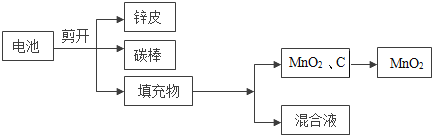
回答下列问题:
(1)干电池工作的化学方程式为Zn+2NH4Cl+2MnO2=ZnCl2+2NH3↑+X+H2O,则X的化学式为______。废电池中的汞会污染水源和土壤,必须进行回收,A同学对锌皮进行如下处理:
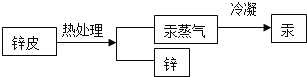
(2)热处理能将锌和汞分离的原理是利用两种金属的_____不同,请你设计一种能去除汞中锌的方案(用化学方程式表示)。______
(3)B同学称取2g二氧化锰和碳的混合物进一步清洗晾干,在氧气流中灼烧至不再有火星出现,将生成气体通入澄清石灰水,得到5g沉淀.计算混合物中二氧化锰的质量分数.(请写出计算过程)_____
(4)用二氧化锰与浓盐酸在微热条件下制取氯气(Cl2),同时生成水和氯化锰(MnCl2),氯化锰中锰元素的化合价为_____,写出反应的化学方程式________。
【答案】Mn2O3 沸点 Zn+2HCl=ZnCl2+H2↑ 70% +2 ![]()
【解析】
(1)根据化学反应遵循质量守恒定律可知,在化学反应前后元素的种类和数目及原子的种类和数都不变,则可利用电池中的化学反应借助守恒的方法判断X的化学式。
(2)根据金属的性质来分析。
(3)利用化学方程式计算出碳的质量然后在进行二氧化锰质量分数的计算。
(4)根据化合物中元素化合价的计算方法以及方程式的书写方法来分析。
(1)由电池工作时反应的化学方程式为:Zn+2MnO2+2NH4Cl═ZnCl2+2NH3↑+X+H2O,可以看出Zn、Cl、H、N四种元素的原子个数在反应前后都相等,而Mn、O两种元素的原子个数反应前后不相等,反应前有2个锰原子,4个氧原子,反应后出现了1个氧原子,所以可以判断则X中应含有2个锰原子和3个氧原子,则X的化学式为Mn2O3。故填:Mn2O3。
(2)锌和汞两种金属的沸点不同,可采用热处理的方法加以分离;在金属活动顺序中,锌排在氢的前面,汞排在氢的后面,所以可采用稀盐酸加以分离。故填:沸点;Zn+2HCl=ZnCl2+H2↑。
(3)在加热时,碳生成了二氧化碳,二氧化碳通入石灰水中产生了碳酸钙沉淀。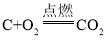 ,
,![]() ,由以上两个化学方程式可知,碳、二氧化碳以及碳酸钙之间的关系为:C~CO2~CaCO3。
,由以上两个化学方程式可知,碳、二氧化碳以及碳酸钙之间的关系为:C~CO2~CaCO3。
设碳的质量为x。
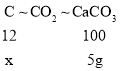
![]()
x=0.6g
混合物中二氧化锰的质量分数为: ![]() 。
。
答:混合物中二氧化锰的质量分数为70%。
(4)在氯化锰(MnCl2)中,氯元素显1价,根据化合物中化合价代数和为0,则锰元素显+2价,二氧化锰与浓盐酸在微热条件下制取氯气(Cl2),同时生成水和氯化锰(MnCl2)反应的方程式为![]() 。故填:+2;
。故填:+2;![]() 。
。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】化学是一门以实验为基础的科学,想要学好化学一定要重视实验。 下列实验都是基于教材上基础实验的创新,请根据下列所示的实验示意图回答问题。
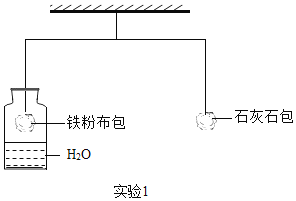
(1)某课外活动中,学生利用实验Ⅰ所示的材料完成探究实验,杠杆已调至平衡。较长时间后,左边铁粉布包下降,将铁粉换成下列物质中的_____ (填序号), 杠杆也会出现相似现象。
A NaCl B NaOH C CaO
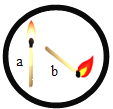
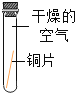
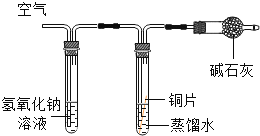
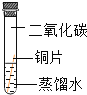
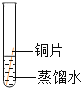
(2)三峡博物馆中展出了大量曾侯乙墓青铜器,一件件铜器精美得让人叹为观止。下图是探究铜片生锈条件的实验,会出现明显现象的是试管D,说明铜生锈实际上是铜与_____发生反应(填化学式)。
实验装置 |
A |
B |
C |
D |
实验现象 | 铜片不生锈 | 铜片不生锈 | 铜片不生锈 | 铜片生锈且水面 附近锈蚀最严重 |
(3)根据下图所给装置回答问题
①如果用装置A制氧气,则所用药品为_____(填化学式)。
②实验室用锌跟稀盐酸反应来制取氢气,其化学方程式为_____。
用这种方法制得的氢气常带有少量的HCl气体和水蒸气。若要制取一瓶纯净干燥的氢气,装置正确的连接顺序是B_____(填C、D和E)。