题目内容
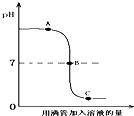 盐酸和氢氧化钠溶液(滴有酚酞试液)发生反应过程中溶液的pH值变化如图.下列有关该实验事实的说法错误的是
盐酸和氢氧化钠溶液(滴有酚酞试液)发生反应过程中溶液的pH值变化如图.下列有关该实验事实的说法错误的是
- A.B点表示盐酸和氢氧化钠恰好完全反应
- B.该实验是将氢氧化钠滴入盐酸溶液中
- C.B点和C点时,溶液均呈现无色
- D.实验通过证明碱溶液的消失来证明发生了中和反应
B
分析:氢氧化钠溶液呈碱性,其pH大于7,盐酸呈酸性,其pH小于7,氢氧化钠溶液和盐酸可以发生中和反应,恰好完全反应时其pH等于7,氢氧化钠过量时显碱性,盐酸过量时显酸性,可以据此结合题给的选项进行解答.
解答:A、从图中可以看出B点的pH值为7,所以可以判断该点为盐酸和氢氧化钠溶液恰好完全反应,故A说法正确;
B、从图中可以看出,溶液的起始的pH大于7,所以可以判断起初的溶液为氢氧化钠溶液,即该实验时将盐酸滴入氢氧化钠溶液中,故B说法错误;
C、无色酚酞遇酸性和中性溶液都不变色,而B点的pH=7,C点的pH小于7,所以这两点的溶液都为无色,故C说法正确;
D、本实验借助于无色酚酞遇碱液变红,而在中性和酸性溶液中都不变色,从而判断碱溶液消失,说明盐酸和氢氧化钠溶液发生了中和反应,故D说法正确.
故选B.
点评:本题以图象的形式考查了酸碱中和反应过程中溶液pH的变化,完成此题,要抓住曲线变化的趋势和关键点的意义.
分析:氢氧化钠溶液呈碱性,其pH大于7,盐酸呈酸性,其pH小于7,氢氧化钠溶液和盐酸可以发生中和反应,恰好完全反应时其pH等于7,氢氧化钠过量时显碱性,盐酸过量时显酸性,可以据此结合题给的选项进行解答.
解答:A、从图中可以看出B点的pH值为7,所以可以判断该点为盐酸和氢氧化钠溶液恰好完全反应,故A说法正确;
B、从图中可以看出,溶液的起始的pH大于7,所以可以判断起初的溶液为氢氧化钠溶液,即该实验时将盐酸滴入氢氧化钠溶液中,故B说法错误;
C、无色酚酞遇酸性和中性溶液都不变色,而B点的pH=7,C点的pH小于7,所以这两点的溶液都为无色,故C说法正确;
D、本实验借助于无色酚酞遇碱液变红,而在中性和酸性溶液中都不变色,从而判断碱溶液消失,说明盐酸和氢氧化钠溶液发生了中和反应,故D说法正确.
故选B.
点评:本题以图象的形式考查了酸碱中和反应过程中溶液pH的变化,完成此题,要抓住曲线变化的趋势和关键点的意义.

练习册系列答案
相关题目
 (2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
(2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
 (2013?怀柔区一模)酸、碱溶液是化学常见的物质,依据所给内容回答问题:
(2013?怀柔区一模)酸、碱溶液是化学常见的物质,依据所给内容回答问题: