题目内容
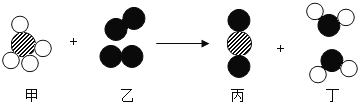
【题目】氨的催化氧化是制硝酸的主要反应之一。下图是该反应的微观示意图。该反应前后化合价没有发生变化的元素为____。生成丙和丁的质量比为__。由微观变化图,可总结出化学变化的实质是__。
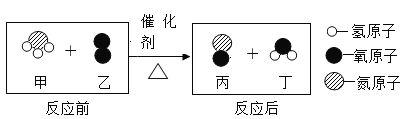
【答案】H 10: 9 分子破裂成原子,原子重新组合成新的分子
【解析】
有微观示意图可得:甲乙丙丁分别为:NH3、O2、NO和H2O,N化合价由氨气中的-3价变为一氧化氮中的+2价,氢元素在氨气中为+1价,到水中还是+1价,故氢元素化合价不变。氧元素在氧气单质中的化合价为0,到一氧化氮和水中都是-2价。故化合价不变的元素是氢元素;反应的化学方程式和对应的质量关系为: ,所以生成丙和丁的质量比为120:108,化简后为:10:9;由图可以看出甲乙中的原子和丙丁中的原子种类一样,再根据方程式得出,化学变化的实质为:分子破裂成原子,原子重新组合成新的分子。故填:H;10:9;分子破裂成原子,原子重新组合成新的分子。
,所以生成丙和丁的质量比为120:108,化简后为:10:9;由图可以看出甲乙中的原子和丙丁中的原子种类一样,再根据方程式得出,化学变化的实质为:分子破裂成原子,原子重新组合成新的分子。故填:H;10:9;分子破裂成原子,原子重新组合成新的分子。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
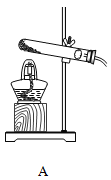
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】为验证质量守恒定律,某学习小组做了镁条在空气中燃烧的实验(图1)。
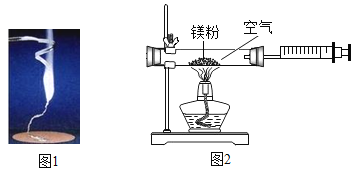
(1)请写出镁条与氧气反应的化学方程式_________________。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是______________。
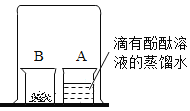
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
[查阅资料]①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2) 固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
[提出问题]黄色固体是什么呢?
[做出猜想]黄色固体为Mg3N2
[实验探究]
实验操作 | 实验现象及结论 |
如图,取燃烧产物中的黄色固体于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
| 现象:____________。 结论:燃烧产物中含Mg3N2 |
[反思与交流]
空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,请给出合理的解释______________。
[拓展延伸]
①根据题意,2.40g 镁条在空气中完全燃烧,所得固体质量为m,则m的取值范围____________。
②反思实验探究过程,谈谈你对物质燃烧条件的新认识__________。
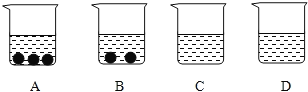
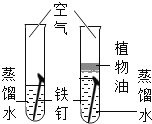
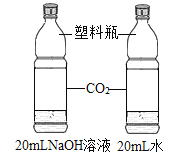
【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的的是
编号 | ① | ② | ③ | ④ |
实验设计 |
|
|
|
|
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究可燃物燃烧的条件 | 探究铁生锈的条件 | 探究CO2与NaOH溶液能否发生反应 |
A.AB.BC.CD.D