题目内容
实验是学习化学的重要手段,通过实验可以培养实践能力和创新精神.
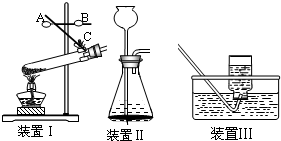
(一)实验室制取气体是初中一类重要的实验,结合下列仪器或装置图回答有关问题:
(1)装置I是用高锰酸钾制氧气,反应的化学方程式为
(2)某同学用装置Ⅱ制取并收集二氧化碳,用燃着的木条放在集气瓶口验满,始终未发现火焰熄灭,原因是
(3)用装置Ⅲ进行二氧化锰和双氧水制取氧气的实验时,若反应速率过快,可以采取的处理方法是
(4)我们已经学过实验室制取O2、CO2、H2三种气体的反应原理及制取、收集方法.请你归纳出制取这三种气体时反应的共同点
A.需要加热 B.需使用催化剂
C.没有气体参加反应 D.生成的气体只有一种
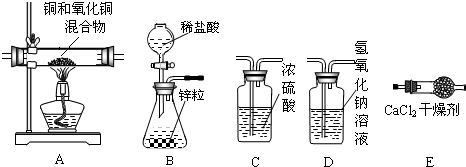
(二)选用下列装置测定水的元素组成,请回答问题:
(5)为准确测定水的组成并防止杂质、空气等干扰,导管口的正确连接顺序为:
③→
(6)若测得A装置中样品在实验后减少了6.4克,E装置质量增加了7.2克,F装置增加了0.1克,据此可求出水中H、O元素质量比为(只写计算式)
(7)实验结束后,若A处仍有黑色固体,这对实验结果的影响是

(一)实验室制取气体是初中一类重要的实验,结合下列仪器或装置图回答有关问题:
(1)装置I是用高锰酸钾制氧气,反应的化学方程式为
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,表明氧气已经收满的实验现象是
| ||
瓶口有气泡冒出
瓶口有气泡冒出
.(2)某同学用装置Ⅱ制取并收集二氧化碳,用燃着的木条放在集气瓶口验满,始终未发现火焰熄灭,原因是
长颈漏斗没有伸入液面下
长颈漏斗没有伸入液面下
.(3)用装置Ⅲ进行二氧化锰和双氧水制取氧气的实验时,若反应速率过快,可以采取的处理方法是
旋转分液漏斗活塞,减慢溶液的下滴速率
旋转分液漏斗活塞,减慢溶液的下滴速率
.(4)我们已经学过实验室制取O2、CO2、H2三种气体的反应原理及制取、收集方法.请你归纳出制取这三种气体时反应的共同点
CD
CD
(填选项序号).A.需要加热 B.需使用催化剂
C.没有气体参加反应 D.生成的气体只有一种
(二)选用下列装置测定水的元素组成,请回答问题:
(5)为准确测定水的组成并防止杂质、空气等干扰,导管口的正确连接顺序为:
③→
⑦
⑦
→⑥
⑥
→④
④
→⑤
⑤
→①→②→⑧→⑨→⑩.(6)若测得A装置中样品在实验后减少了6.4克,E装置质量增加了7.2克,F装置增加了0.1克,据此可求出水中H、O元素质量比为(只写计算式)
(7.2-6.4):6.4
(7.2-6.4):6.4
.(7)实验结束后,若A处仍有黑色固体,这对实验结果的影响是
无影响
无影响
(填“氧的质量偏大”、“氢的质量偏大”、“无影响”).分析:(一)(1)根据高锰酸钾加热生成锰酸钾、二氧化锰和氧气进行解答;
(2)根据II装置中长颈漏斗没有伸入液面下回答问题即可;
(3)根据控制双氧水的流速来控制反应速率进行解答;
(4)根据O2、CO2、H2三种气体的反应原理以及三种气体的性质进行解答;
(二)(5)实验室若用锌和稀盐酸制取氢气时,因盐酸易挥发,所以制得的氢气内混有少量HCl气体和水蒸气,欲得到纯净、干燥的H2,必须除掉HCl气体和水蒸气进行解答;
(6)利用反应前后减小的是氧化铜中的氧,E装置质量增加是反应生成水的质量进行计算;
(7)根据对氧元素和水的质量不变进行解答.
(2)根据II装置中长颈漏斗没有伸入液面下回答问题即可;
(3)根据控制双氧水的流速来控制反应速率进行解答;
(4)根据O2、CO2、H2三种气体的反应原理以及三种气体的性质进行解答;
(二)(5)实验室若用锌和稀盐酸制取氢气时,因盐酸易挥发,所以制得的氢气内混有少量HCl气体和水蒸气,欲得到纯净、干燥的H2,必须除掉HCl气体和水蒸气进行解答;
(6)利用反应前后减小的是氧化铜中的氧,E装置质量增加是反应生成水的质量进行计算;
(7)根据对氧元素和水的质量不变进行解答.
解答:解:(一)(1)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑;氧气已经收满的实验现象是瓶口有气泡冒出;
(2)II装置中长颈漏斗没有伸入液面,所以某同学用装置Ⅱ制取并收集二氧化碳,用燃着的木条放在集气瓶口验满,始终未发现火焰熄灭;
(3)控制双氧水的流速来控制反应速率,若反应速率过快,可以采取的处理方法是旋转分液漏斗活塞,减慢溶液的下滴速率;
(4)O2、CO2、H2三种气体的反应原理以及三种气体的性质可知,三种气体时反应的共同点没有气体参加反应和生成的气体只有一种;
(二)(5)实验室若用锌和稀盐酸制取氢气时,因盐酸易挥发,所以制得的氢气内混有少量HCl气体和水蒸气,欲得到纯净、干燥的H2,必须除掉HCl气体和水蒸气,导管口的正确连接顺序为:③→⑥→④→⑤→①→②→⑧→⑨→⑩;
(6)利用反应前后减小的是氧化铜中的氧,E装置质量增加是反应生成水的质量可知,氧元素的质量为6.4g,水的质量为7.2g,所以水中H、O元素质量比为(7.2-6.4):6.4;
(7)由于通过各装置的变化量测定氢、氧元素的质量,丁处仍有黑色固体,说明固体剩余,但是氧元素与氢元素是按一定比例生成水的,这对实验结果的影响是无影响.
故答案为:(1)2KMnO4
K2MnO4+MnO2+O2↑;瓶口有气泡冒出;
(2)长颈漏斗没有伸入液面下;
(3)旋转分液漏斗活塞,减慢溶液的下滴速率;(4)CD;(5)⑦⑥④⑤;
(6)(7.2-6.4):6.4;(7)无影响.
| ||
(2)II装置中长颈漏斗没有伸入液面,所以某同学用装置Ⅱ制取并收集二氧化碳,用燃着的木条放在集气瓶口验满,始终未发现火焰熄灭;
(3)控制双氧水的流速来控制反应速率,若反应速率过快,可以采取的处理方法是旋转分液漏斗活塞,减慢溶液的下滴速率;
(4)O2、CO2、H2三种气体的反应原理以及三种气体的性质可知,三种气体时反应的共同点没有气体参加反应和生成的气体只有一种;
(二)(5)实验室若用锌和稀盐酸制取氢气时,因盐酸易挥发,所以制得的氢气内混有少量HCl气体和水蒸气,欲得到纯净、干燥的H2,必须除掉HCl气体和水蒸气,导管口的正确连接顺序为:③→⑥→④→⑤→①→②→⑧→⑨→⑩;
(6)利用反应前后减小的是氧化铜中的氧,E装置质量增加是反应生成水的质量可知,氧元素的质量为6.4g,水的质量为7.2g,所以水中H、O元素质量比为(7.2-6.4):6.4;
(7)由于通过各装置的变化量测定氢、氧元素的质量,丁处仍有黑色固体,说明固体剩余,但是氧元素与氢元素是按一定比例生成水的,这对实验结果的影响是无影响.
故答案为:(1)2KMnO4
| ||
(2)长颈漏斗没有伸入液面下;
(3)旋转分液漏斗活塞,减慢溶液的下滴速率;(4)CD;(5)⑦⑥④⑤;
(6)(7.2-6.4):6.4;(7)无影响.
点评:(一)此题是化学实验基本操作与综合应用考查题,解题时要对常规的实验有明确的认识,并且能对综合实验的问题进行深入的探讨;(二)是典型的实验探究题,熟练掌握氢气还原氧化铜的性质和实验才能准确解答该题,要分析清楚每步实验的目的即可准确解答该题.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目