题目内容
将 146.6 g稀硫酸与5.6g铁粉恰好完全反应,求:
(1)生成氢气生成氢气的质量;(2)反应后所得硫酸亚铁溶液中溶质的质量分数。
(1)生成氢气生成氢气的质量;(2)反应后所得硫酸亚铁溶液中溶质的质量分数。
(1)0.2g (2)10%
设所得溶液的溶质质量为x,生成氢气的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 152 2
5.6g x y
(1)56:2=5.6g:y 解得 y="0.2g"
(2)56:152=5.6g:x 解得 x=15.2g
则反应后溶质质量分数为
溶质质量分数=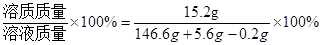 =10%。
=10%。
答:(1)生成氢气的质量为0.2g.
(2)反应后所得溶液溶质质量分数为10%。
Fe+H2SO4=FeSO4+H2↑
56 152 2
5.6g x y
(1)56:2=5.6g:y 解得 y="0.2g"
(2)56:152=5.6g:x 解得 x=15.2g
则反应后溶质质量分数为
溶质质量分数=
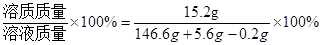 =10%。
=10%。答:(1)生成氢气的质量为0.2g.
(2)反应后所得溶液溶质质量分数为10%。

练习册系列答案
相关题目
 2NaOH+H2↑+Cl2↑,若生产100 kgNaOH,理论上产生H2多少千克?
2NaOH+H2↑+Cl2↑,若生产100 kgNaOH,理论上产生H2多少千克? C (金刚石)+2Na2O
C (金刚石)+2Na2O