题目内容
【题目】等质量的铁粉与过量的盐酸在不同的实验条件下进行反应,测定在相同时间t内产生气体体积V的数据,根据数据绘制得到图1。
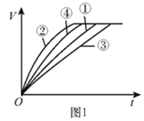
组别 | 盐酸的溶质质量分数/% | 温度/℃ |
① | 7 | 30 |
② | 10 | 50 |
③ | 7 | 20 |
④ | 10 | 30 |
(1)请写出铁粉与稀盐酸反应的化学方程式:________。
(2)通过实验①③对比,得出的结论是________;要比较盐酸的溶质质量分数对反应快慢的影响,应选择的实验组别是________。
(3)实验中产生气体“逐渐变快又变慢”的原因是________。
(进一步探究)图甲、图乙为利用数字化仪器测得的室温下足量的三种金属片分别与20 mL 10%的稀盐酸反应产生氢气的量(产生氢气的量由气体压强表示,在等温条件下,产生氢气的体积与装置内压强成正比)。
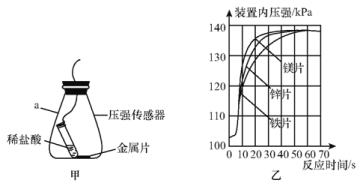
①实验中你认为还要控制的变量是________。
②根据图乙,你得出的反应物的量与生成的气体体积的关系是________。
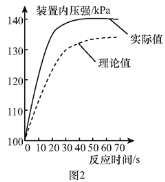
(拓展提高)图2为测得的室温下足量的镁片与20 mL 10%的稀盐酸反应产生氢气的量与时间的关系曲线,发现实验测得的实际值比通过计算得到的理论值偏大,请分析可能的原因(至少答两点):
①________;②________。
【答案】 Fe+2HCl=FeCl2+H2↑ 其他条件相同时,温度越高,铁与盐酸反应速率越快 ①④ 反应放热,开始反应时温度逐渐升高,反应速率加快;随着反应的进行,酸的浓度降低,反应速率减慢 金属颗粒的大小 足量的不同金属分别与相同体积、相同质量分数的同种酸充分反应,生成氢气的质量相等 反应放热,使气体膨胀 氢气中混入了氯化氢气体
【解析】(1)铁粉与稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;(2)①③盐酸的浓度相同,温度不同,由图象可以得出的结论是:其他条件相同时,温度越高,铁与盐酸反应速率越快;要比较盐酸的溶质质量分数对反应快慢的影响,必须选择温度相同,盐酸的溶质质量分数不同,分析表中数据,只有①④数据符合;(3)金属与酸反应放出热量,开始反应时温度逐渐升高,反应速率加快;随着反应的进行,酸的浓度降低,反应速率又减慢;【进一步探究】①足量的相同颗粒大小的锌片、铁片、镁条分别与20毫升10%的稀盐酸反应,从图中可以看出,盐酸完全反应后,生成氢气的质量相等;②由图乙,你得出的反应物的量与生成的气体体积的关系是足量的不同金属分别与相同体积相同质量分数的相同的酸充分反应,生成氢气质量相等;【拓展提高】如图2为测得的室温条件下足量的镁片与20ml10%的稀盐酸反应产生氢气的量与时间的关系曲线,发现实验测得的实际值比通过计算得到的理论值偏大,请分析可能的原因:①反应放热,使气体膨胀;②氢气中混入了氯化氢气体。