题目内容
【题目】ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒.制取ClO2的反应过程示意图如下:
![]()
(其中,![]() 表示钠原子,
表示钠原子,![]() 表示氯原子,
表示氯原子,![]() 表示氧原子)请回答题:
表示氧原子)请回答题:
(1)A物质中氯元素的化合价为_____.
(2)D物质的名称是_____.
(3)该反应的化学方程式是_____.
【答案】+3 二氧化氯 ![]()
【解析】
由制取ClO2的反应过程示意图,可知反应的方程式是:2NaClO2+Cl2═2NaCl+2ClO2.
(1)由A物质的微观构成可知,A物质是NaClO2,由于氧显﹣2价,钠显+1价,由化合价原则可求出氯元素的化合价为+3.
(2)由D物质的构成可知,D物质的名称是二氧化氯.
(3)由上述分析可知,该反应的化学方程式是:2NaClO2+Cl2═2NaCl+2ClO2.
故答为:(1)+3;(2)二氧化氯;(3):2NaClO2+Cl2═2NaCl+2ClO2.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
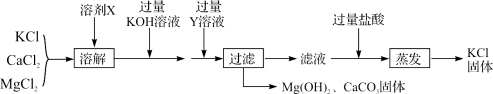
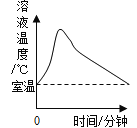
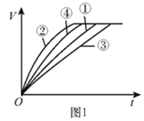
能考试全能100分系列答案【题目】等质量的铁粉与过量的盐酸在不同的实验条件下进行反应,测定在相同时间t内产生气体体积V的数据,根据数据绘制得到图1。
组别 | 盐酸的溶质质量分数/% | 温度/℃ |
① | 7 | 30 |
② | 10 | 50 |
③ | 7 | 20 |
④ | 10 | 30 |
(1)请写出铁粉与稀盐酸反应的化学方程式:________。
(2)通过实验①③对比,得出的结论是________;要比较盐酸的溶质质量分数对反应快慢的影响,应选择的实验组别是________。
(3)实验中产生气体“逐渐变快又变慢”的原因是________。
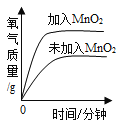
(进一步探究)图甲、图乙为利用数字化仪器测得的室温下足量的三种金属片分别与20 mL 10%的稀盐酸反应产生氢气的量(产生氢气的量由气体压强表示,在等温条件下,产生氢气的体积与装置内压强成正比)。
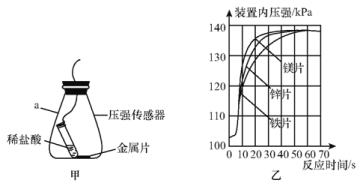
①实验中你认为还要控制的变量是________。
②根据图乙,你得出的反应物的量与生成的气体体积的关系是________。
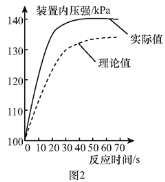
(拓展提高)图2为测得的室温下足量的镁片与20 mL 10%的稀盐酸反应产生氢气的量与时间的关系曲线,发现实验测得的实际值比通过计算得到的理论值偏大,请分析可能的原因(至少答两点):
①________;②________。
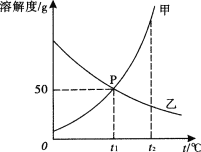
【题目】下列四个图象中,能正确表示对应变化关系的是( )
A | B | C | D |
|
|
|
|
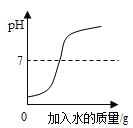
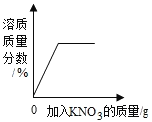
向一定量稀盐酸中加水 | 20℃时,向一杯饱和KNO3溶液中加入KNO3晶体 | 室温时,向一定量的稀盐酸中加入少量镁条 | 用等质量、等浓度的双氧水分别制取氧气 |
A. AB. BC. CD. D