题目内容
【题目】下列说法中,符合质量守恒定律的是 ( )
A.电解8g水可得4g氢气和4g氧气B.6g的碳与6g氧气反应生成12g二氧化碳
C.8g氧气与1g氢气化合生成9g水D.6g氧气与2g碳反应生成8g二氧化碳
【答案】C
【解析】
A、电解水的化学方程式为: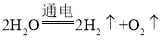 生成氢气、氧气的质量比为 1:8,不符合题意;
生成氢气、氧气的质量比为 1:8,不符合题意;
B、碳与氧气反应的化学方程式为: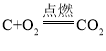 ,碳与氧气反应时的质量比为:3:8,故碳过量,无法生成12g二氧化碳,不符合题意;
,碳与氧气反应时的质量比为:3:8,故碳过量,无法生成12g二氧化碳,不符合题意;
C、氧气与氢气化合生成水的化学方程式为: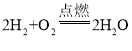 ,反应的氢气与氧气的质量比为:1:8,故8g氧气可与1g氢气化合生成9g水,符合质量守恒定律,符合题意;
,反应的氢气与氧气的质量比为:1:8,故8g氧气可与1g氢气化合生成9g水,符合质量守恒定律,符合题意;
D、碳与氧气反应的化学方程式为: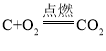 ,碳与氧气反应时的质量比为:3:8,可知氧气过量,无法生成8g二氧化碳,不符合题意。
,碳与氧气反应时的质量比为:3:8,可知氧气过量,无法生成8g二氧化碳,不符合题意。
故选C。

 口算能手系列答案
口算能手系列答案【题目】在一个密闭容器内有四种物质,在一定条件下完全反应后,测得反应前后各物质的质量如下:
物质 | X | Y | Z | Q |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量/g | 0 | 12 | 15 | 待测 |
已知X的相对分子质量为N,Q的相对分子质量为2N,下列推理正确的是( )
A. 反应后Q的质量为9 g
B. 反应中Y与Q发生改变的质量之比为1∶1
C. 反应后生成15 g Z
D. X与Q反应前的化学计量数之比为2∶1
【题目】NaOH在工业上具有广泛的应用,某研究性学习小组通过以下实验探究NaOH的性质。
实验一 向两块固体表面滴加稀盐酸 | 实验二 振荡2个塑料瓶 |
|
|
(1)实验一中滴加盐酸后产生的气泡的化学式为_______________。
(2)实验二中振荡2个塑料瓶,观察到塑料瓶变瘪的程度为A>B, A瓶出现沉淀,B瓶中先有白色沉淀,继续振荡后沉淀消失。
①请说出一-种鉴别NaOH固体和Ca(OH)2固体的物理方法:__________________。
②B瓶中产生沉淀的化学方程式为_________________。
(3)在20°C时,研究小组对A瓶中产生沉淀的原因及成分做了如下探究:
[提出问题]两只塑料瓶中发生了哪些反应,得到了哪些物质?
[查阅资料]①20°C时,有关物质的溶解度如下表所示:
物质 | NaOH | Ca(OH)2 | Na2CO3 | NaHCO3 | CaCO3 | Ca(HCO3)2 |
溶解度/g | 109 | 0.18 | 21.5 | 9.6 |
| 16.6 |
②CO2可以与Na2CO3溶液发生反应: ![]() 。
。
③NaHCO3固体在120°C开始分解: ![]() 。Na2CO3 加热不分解。
。Na2CO3 加热不分解。
④常温下,饱和Na2CO3溶液pH为12.3, 饱和NaHCO3溶液pH为8.1。
根据以上资料和实验现象推断:B瓶最终所得澄清溶液中所含溶质为____________。
[提出猜想]对A瓶中沉淀成分有以下四种猜想:猜想Ⅰ : NaOH和Na2CO3;
猜想Ⅱ: Na2CO3; 猜想Ⅲ: Na2CO3 和NaHCO3; 猜想Ⅳ: NaHCO3。
小组同学经过讨论分析后,认为“猜想I”不成立,其理由是___________________。
[实验探究]将A瓶固体过滤后,用冰水洗涤,在烘箱中烘干。烘箱温度应控制为_______________。
小组甲:取2g固体溶于98gH2O配成溶液,用pH试纸测得其pH约为11。则_______________(填“猜想Ⅱ”、“猜想Ⅲ”、“猜想Ⅳ”)不成立。.
小组乙:取干燥固体在硬质大试管中加热,并将导管通入装有澄清石灰水的烧杯中。加热过程中,一直未见烧杯中有沉淀产生;将试管中固体冷却后称量, 其质量__________(填“变大”“变小”或“不变”)。
[实验结论]____________(填“猜想Ⅱ”、“猜想Ⅲ”、“猜想Ⅳ”)是正确的。
[反思评价]若不进行实验操作,仅通过比较塑料瓶中气体和溶液中溶质质量的相对关系,也可推断出A瓶中所得产物种类,还需要查阅或测量的数据是_______________。