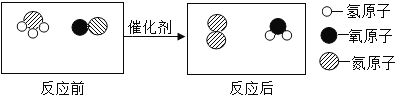
题目内容
【题目】可燃冰是一种新型能源,在我国南海储量很高,其主要成分为甲烷(CH4),CH4能还原CuO,某化学兴趣小组同学设计实验探究CH4还原CuO的反应。
(提出问题) CH4还原CuO的反应产物是什么?
(查阅资料)①白色的无水硫酸铜固体遇水变蓝色;②氧化亚铜(Cu2O)和铜均为红色固体,且Cu2O能和稀硫酸反应,反应的化学方程式为![]() 。
。
(实验探究)
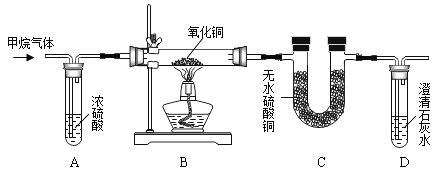
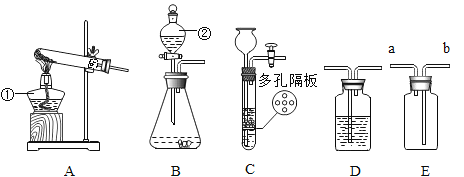
(1)实验开始时,应进行的操作是___________(填字母)。
a 先通纯净的甲烷,后加热氧化铜
b 先加热氧化铜,后通纯净的甲烷
(2)点燃酒精灯,通入足量的甲烷,一段时间后B装置内的现象是黑色固体变为红色,证明有铜生成。
(3)反应过程中,C装置中白色的无水硫酸铜固体变蓝色,证明有_________________生成。
(4)D装置内澄清石灰水变浑浊,证明有__________________生成,澄清石灰水变浑浊的化学方程式为______________________。
(实验反思)
(5)浓硫酸的作用是______________________。
(6)实验过程中可能会产生一氧化碳,从环保角度考虑,你认为如图实验需要改进之处是___________。
(实验拓展)
(7)实验结束后小可认为B装置内的红色固体可能是氧化亚铜,为验证其猜想,小可设计如下实验方案:
实验操作 | 现象 | 结论 |
取少量红色固体于试管中,加入过量的稀硫酸 | ___________ | 红色固体是Cu2O |
小红认为小可的结论不合理,因为B装置中的红色固体可能是Cu和Cu2O的混合物,于是她进行了以下实验:称取m g红色固体于试管中,加入过量的稀硫酸充分反应,然后过滤、洗涤、干燥称量,得到ng固体。当n>__________,(含m的代数式)时,证明小红的猜想合理。
【答案】a 水 二氧化碳 ![]() 于燥甲烷气体(或除去甲烷中的水蒸气) 在D装置右侧导管口处放一盏燃着的酒精灯(或系一只气球) 溶液变蓝色,有红色固体剩余 4m/9
于燥甲烷气体(或除去甲烷中的水蒸气) 在D装置右侧导管口处放一盏燃着的酒精灯(或系一只气球) 溶液变蓝色,有红色固体剩余 4m/9
【解析】
实验探究:(1)甲烷具有可燃性,混有一定量的空气遇明火会发生爆炸,故应先通纯净的甲烷,将装置内的空气排尽,后加热氧化铜。
故选a;
(3)无水硫酸铜遇水变蓝,无水硫酸铜固体变为蓝色,说明有水生成;
(4)二氧化碳能使澄清石灰水变浑浊,故D装置内澄清石灰水变浑浊,证明有二氧化碳生成;
澄清石灰水变浑浊,是因为氢氧化钙能与二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:![]() ;
;
实验反思:(5)浓硫酸具有吸水性,且浓硫酸与甲烷不反应,故浓硫酸的作用是:干燥甲烷气体;
(6)一氧化碳有毒,排放到空气中会污染空气,故应增加尾气处理装置,应在D装置右侧导管口处放一盏燃着的酒精灯(或系一只气球);
实验拓展:(7)结论为:红色固体是Cu2O,Cu2O能和稀硫酸反应,反应的化学方程式为![]() ,铜不与稀硫酸反应,故实验现象为:溶液变蓝色,有红色固体剩余;
,铜不与稀硫酸反应,故实验现象为:溶液变蓝色,有红色固体剩余;
若mg红色固体全部是Cu2O,![]() ,故最后得到的固体是铜,设生成铜的质量是x
,故最后得到的固体是铜,设生成铜的质量是x
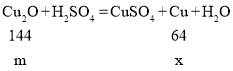
![]() x=4m/9。
x=4m/9。
氧化亚铜反应生成铜,质量减小,故若n=4m/9,则红色固体全部是氧化亚铜,如果n>4m/9
,则红色固体是铜和氧化亚铜的混合物,故填:4m/9。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案