题目内容
【题目】氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
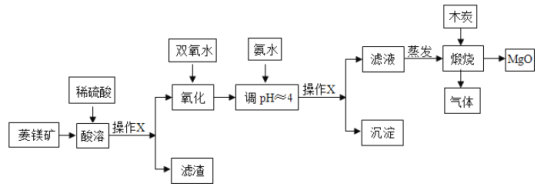
(1)操作X的名称是_____,该操作需要用到的玻璃仪器主要有:烧杯、_____、玻璃棒.
(2)蒸发过程中,要用玻璃棒不断地搅拌,其目的是_____.
(3)碳酸镁与稀硫酸反应的化学方程式为_____;该反应属于_____反应.
(4)加入双氧水氧化时,发生反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2X.则X的化学式为_____.
(5)煅烧过程存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C
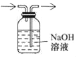
MgO+SO2↑+CO↑;MgSO4+3C![]() MgO+S↑+3CO↑.利用下图装置对煅烧产生的气体进行分步吸收或收集.
MgO+S↑+3CO↑.利用下图装置对煅烧产生的气体进行分步吸收或收集.
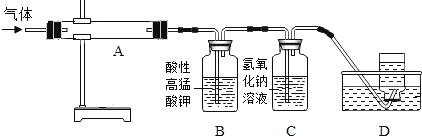
资料:酸性高锰酸钾能吸收二氧化硫;硫蒸气在A装置冷凝成固体.
①上述反应产生的气态氧化物中_____(填化学式)不会对空气造成污染.
②D中收集到的气体具有_____(填一种化学性质).
③C中发生反应的化学方程式为_____.
(6)若直接煅烧100t含碳酸镁84%的菱镁矿,理论上可制得氧化镁多少_____?
【答案】过滤 漏斗 使液体均匀受热,防止液体外溅 MgCO3+H2SO4═MgSO4+H2O+CO2↑ 复分解 H2O CO2 可燃性或还原性 2NaOH+CO2═Na2CO3+H2O 40t
【解析】
(1)操作X的名称是过滤,通过过滤把不溶于水的固体分离出来,该操作需要用到的玻璃仪器主要有:烧杯、漏斗、玻璃棒;
(2)蒸发过程中,要用玻璃棒不断地搅拌,其目的是使液体均匀受热,防止液体外溅;
(3)碳酸镁与稀硫酸反应生成硫酸镁、水和二氧化碳,反应的化学方程式为:MgCO3+H2SO4═MgSO4+H2O+CO2↑,属于复分解反应;
(4)由2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2X可知,反应前后铁原子都是2个,硫原子都是3个,反应前氧原子是14个,反应后应该是14个,其中2个包含在2X中,反应前氢原子是4个,反应后应该是4个,包含在2X中,因此每个X中含有2个氢原子和1个氧原子,是水,水的化学式为H2O;
(5)①上述反应产生的气态氧化物中,二氧化硫和一氧化碳能够污染环境,而二氧化碳不会对空气造成污染,二氧化碳的化学式是CO2;
②D中收集到的气体是一氧化碳,一氧化碳具有可燃性、还原性;
③C中氢氧化钠和二氧化碳反应生成碳酸钠和水,发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O;
(6)设理论上可制得氧化镁质量为x,
因为MgCO3~MgSO4,MgSO4~MgO,所以MgCO3~MgO,
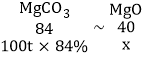
![]()
x=40t,
答:若直接煅烧100t含碳酸镁84%的菱镁矿,理论上可制得氧化镁40t。

【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
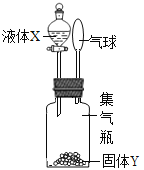
A. ①②⑤ B. ①③④ C. ①②④ D. ②③⑤