��Ŀ����
����Ŀ����2014���Ĵ�ʡ�ɶ������������������Ĵ��������������⣬ij�����������������������д������ۺ����õIJ����������£�
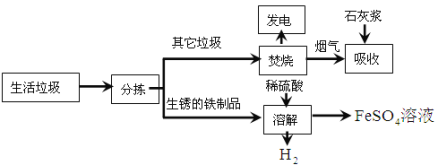
����1���������ղ����������к���![]() ���к����塣
���к����塣
����2��+2�۵���Ԫ�����ױ������е�����������
�ش��������⣺
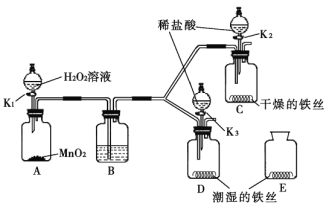
��1�����糧�������������ղ����� ת��Ϊ���ܡ�
��2�����ղ����У�ʯ�ҽ��������� ��
��3���ܽⲽ���У�������![]() �Ļ�ѧ����ʽΪ ��
�Ļ�ѧ����ʽΪ ��
���˷�Ӧ�⣬�ܽⲽ�軹�ܷ���������Ӧ��
��Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
��Fe+ Fe2(SO4)3=3 FeSO4���������ڻ��Ϸ�Ӧ���� (�����)����Ӧǰ����Ԫ�صĻ��ϼ۲������ (�����)��
��4������������������Һ�ڵ��������м�������Ũ������ȴ�ᾧ�� (���������)���õ������������壬���е����������� ��
��5������ͳɶ�����������������һ������ ��
���𰸡���1������
��2����ȥ�����к��е�SO2 ��HCl
��3��Fe + H2SO4= FeSO4 + H2�� �� ��
��4������ ������������+2�۵���Ԫ�ر������е���������
��5����������������յ�
��������
�����������1����ѧ��Ӧ���������ı仯�����糧�������������ղ���������ת��Ϊ����
��2�����ղ����У�ʯ�ҽ�����Ҫ�ɷ����������ƣ�����ǽ��������P�������巴Ӧ�����������չ����л��γ�SO2��HCl���к����壬����ʯ�ҽ�����������ȥ�����к��е�SO2 ��HCl����ֱֹ���ŷ���Ⱦ����
��3���ܽⲽ���У��ǽ�ϡ������뵽���������Ʒ�У�������H2�Ļ�ѧ����ʽΪ��Fe + H2SO4 = FeSO4 + H2�������Ϸ�Ӧ�������ֻ��������ϵ�����������һ�����ʵķ�Ӧ���������ڻ��Ϸ�Ӧ�����������ݻ��ϼ۵�һ����ɣ��ڻ������У��������ϼ۵Ĵ�����Ϊ0���ҽ�ϸ��ֽⷴӦ��������ֻ����ﻥ�ཻ���ɷ֣������������ֻ�����ķ�Ӧ���ص㣺��β��������Ԫ�صĻ��ϼ۲��䣬���Է�Ӧǰ����Ԫ�صĻ��ϼ۲������
��4������������������Һ�ڵ��������м�������Ũ������ȴ�ᾧ�����ˣ����ɵõ������������壬������Ŀ���ṩ������2����ϵ����Ļ�ѧ���ʲ����ã��������������������е����������ǣ�������������+2�۵���Ԫ�ر������е���������
��5������������������һ�����飺��������������յ�

����Ŀ������������ܽ�ȱ����ܽ�����ߣ��ش��������⣺
�¶�/��C �ܽ��/g | 0 | 20 | 40 | 60 | 80 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
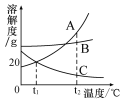
��1���Ȼ�����Һ�е��ܼ��� ��
��2��20��ʱ��NaCl���ܽ���� g��
��3��ͼ���ܱ�ʾKNO3�ܽ�����ߵ��� ���A����B������
��4��20��ʱ����40g KNO3����ʢ��100gˮ���ձ��У�����ܽ⣬�õ��������Һ������Ϊ g������������80�������и���һ�������� ������ĸ��ţ���
A���������� B���ܼ����� C���ܽ�� D�����ʵ���������
��5��ʵ��������500g 10%�Ȼ�����Һ��Ҫ�Ȼ��ƹ������� g��