题目内容
【题目】A、B、C三种固体物质的溶解度曲线如图所示。
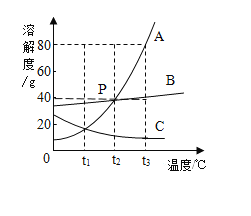
(1)P点的含义是_____。
(2)![]() 时,100g的物质A放入100g水中,充分溶解,所得溶液的溶质质量分数为_____。
时,100g的物质A放入100g水中,充分溶解,所得溶液的溶质质量分数为_____。
(3)将接近饱和的C溶液变为饱和溶液,在不改变溶液质量的前提下可行的是_____。
(4)若将A物质从A和少量B的混合溶液中分离出来,宜采用的方法是_____。
【答案】t2℃时,A和B的溶解度相同且为40g 44.4% 升温至饱和 降温结晶
【解析】
(1)P点的含义是:t2℃时,A和B的溶解度相同且为40g;故答案为:t2℃时,A和B的溶解度相同且为40g;
(2)t3℃时,A的溶解度为80g,100g的物质A放入100g水中,充分溶解,所得溶液的溶质质量分数:![]() ;故答案为:44.4%;
;故答案为:44.4%;
(3)将接近饱和的C溶液变为饱和溶液,在不改变溶液质量的前提下可行的是升温至饱和,因为C的溶解度随温度的升高而减少;故答案为:升温至饱和;
(4)若将A物质从A和少量B的混合溶液中分离出来,宜采用的方法是:降温结晶,因为A的溶解度受温度的影响变化比B大;故答案为:降温结晶;

 能考试期末冲刺卷系列答案
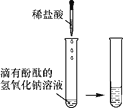
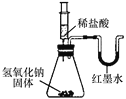
能考试期末冲刺卷系列答案【题目】某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象。
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量。
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告。
同学 | 实验操作 | 现象 | 结论 |
甲 |
| 溶液由红色变成________ | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为__________ |
乙 |
| U形玻璃管中________边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
丙 | 用________测定氢氧化钠溶液的pH;向其中滴加足量的稀盐酸后,再测定溶液的pH | 最后溶液的pH________(填“≥7”“≤7”或“不变”) | 氢氧化钠与盐酸发生了化学反应 |
【评价反思】你认为实验设计方案不合理的同学是________,理由是______________________________。