题目内容
【题目】某化学兴趣小组为探究铁、铜、锌、银的金属活动性顺序。设计了如图所示的三个实验(其中金属均已打磨,且其形状、大小相同;所用盐酸的溶质质量分数、用量也相同)下列判断中,错误的是( )
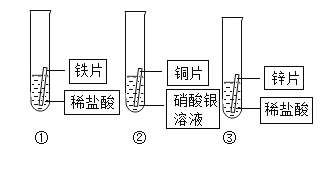
A.通过上述三个实验,不能判断出四种金属的活动性顺序
B.通过实验①和③的反应剧烈程度,可以判断出铁和锌的金属活动性强弱
C.若增加一个铜锌活动性比较的实验,则可判断出四种金属的活动性顺序
D.通过实验②的反应现象,可以判断出铜和银的金属活动性强弱
【答案】C
【解析】
A. 通过上述①和③两个实验,锌和铁与酸反应的剧烈程度可以比较锌铁的活动性强弱(锌>铁),通过②可以比较铜银的活动性强弱(铜>银),但是不能判断出铁和铜的活动性强弱,不能比较四种金属的活动性顺序。故A不符合题意;
B. 金属均已打磨,且其形状、大小相同;所用盐酸的溶质质量分数、用量也相同,通过实验①和③的反应剧烈程度,可以判断出铁和锌的金属活动性强弱。故B不符合题意;
C. 通过A的分析可知,若增加一个铜锌活动性比较的实验,只能比较锌铜的活动性,还是比较不出铁铜的活动性顺序,仍然不能判断出四种金属的活动性。故C符合题意;
D. 一种金属与另一种金属的盐溶液反应,如果能反应,金属单质的活动性比盐溶液中的金属活动性强,如果不反应,金属单质的活动性比盐溶液中的金属活动性弱,所以通过实验②的反应现象,可以判断出铜和银的金属活动性强弱。故D不符合题意。
故选C。

【题目】小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
(提出问题)氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
(设计实验)小雨以生成等体积的氧气为标准,设计了下列几组实验。
序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
① | 10.0g | 330℃ | 100mL | t1 | |
② | 10.0g | CuO1.5g | 330℃ | 100mL | t2 |
③ | 10.0g | MnO21.5g | 330℃ | 100mL | t3 |
④ | 10.0g | MnO2_____g | 380℃ | 100mL | t4 |
(1)若t1>t2,说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的_____和_____不变。
(2)写出实验④所涉及的化学反应的文字表达式_____。
(3)实验④中MnO2的质量为_____g,若t3>t4,则化学反应快慢与温度的关系是_____。
(4)氯酸钾的分解速率可能还与_____因素有关,请设计实验证明_____。
【题目】某同学进行下图两个实验。
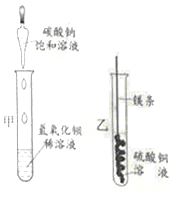
(l)甲实验中反应的化学方程式为____________;
(2)乙实验观察到的现象是___________,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
【查阅资料】硫酸钡不溶于酸。
【提出猜想】 白色沉淀为:Ⅰ._______;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3.
【实验方案】
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为____________。 ②若______且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,________,猜想Ⅲ成立。 |
【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时___________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是__________________。