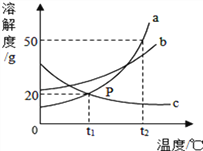
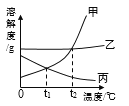
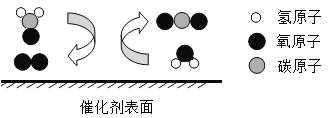
题目内容
【题目】化学用语是学习化学的重要工具。
(1)①2个铝离子 __________ ; ②氢氧化钠变质的产物__________ ;
③最简单的有机物 __________ ④海水中最多的金属元素__________;
⑤3个氢氧根离子__________ ; ⑥人体中含量最多的物质__________。
(2)用化学方程式表示
①产生白烟的化学反应 __________ ②除去氯化钙溶液中的盐酸__________
③碳酸氢铵低温保存的原因 _________ ④氯化铵和熟石灰一起施用后果 __________
【答案】 Al3+ Na2CO3 CH4 Na 3OH+ H2O 4P+5O2 ![]() 2P2O5 Ca﹙OH﹚﹚2 +2HCl=CaCl2 +2H2O NH4HCO3
2P2O5 Ca﹙OH﹚﹚2 +2HCl=CaCl2 +2H2O NH4HCO3![]() NH3 ↑+ H2O + CO2↑ 2NH4Cl+Ca(OH)2 =2NH3 ↑+ 2H2O + CaCl2
NH3 ↑+ H2O + CO2↑ 2NH4Cl+Ca(OH)2 =2NH3 ↑+ 2H2O + CaCl2
【解析】(1)①2个铝离子是2Al3+,离子讲种类,讲个数,离子符号前面数字表示离子个数; ②氢氧化钠变质的产物是Na2CO3,氢氧化钠与二氧化碳反应生成碳酸钠;③最简单的有机物是CH4,甲烷属于最简单的有机物;④海水中最多的金属元素Na,海水中主要成分是氯化钠;⑤3个氢氧根离子是3OH-,离子讲种类,讲个数,离子符号前面数字表示离子个数;⑥人体中含量最多的物质是H2O。(2)①产生白烟的化学反应是4P+5O2 ![]() 2P2O5;②Ca﹙OH﹚﹚2 +2HCl=CaCl2 +2H2O;③碳酸氢铵低温保存的原因是NH4HCO3
2P2O5;②Ca﹙OH﹚﹚2 +2HCl=CaCl2 +2H2O;③碳酸氢铵低温保存的原因是NH4HCO3![]() NH3 ↑+ H2O + CO2↑;④氯化铵和熟石灰一起施用后果是2NH4Cl+Ca(OH)2 =2NH3 ↑+ 2H2O + CaCl2。
NH3 ↑+ H2O + CO2↑;④氯化铵和熟石灰一起施用后果是2NH4Cl+Ca(OH)2 =2NH3 ↑+ 2H2O + CaCl2。
点睛∶分子,原子和离子属于微观离子,讲种类,讲个数。化学方程式的书写应遵循两个原则⑴以客观事实为依据⑵遵循质量守恒定律。

【题目】自动充气气球因使用方便,无需其它充气器材而逐渐得以推广。某化学兴趣小组对自动充气气球进行了如下探究。

(查阅资料)①自动充气气球的结构如图所示,气球的充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
②氯化银是一种白色沉淀且不溶于稀硝酸。
(1)探究液体包的成分:
取液体包中的少量溶液分别放于两只于试管中,在其中一只试管中加入锌粒产生气泡,另一只试管中滴加硝酸银溶液,产生白色沉淀,继续滴加稀硝酸沉淀不溶,则小组同学证明液体包中装的是________,写出该液体与锌粒反应的化学方程式____________。
(2)探究白色粉末成分:
(猜想与假设)甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
(设计并进行实验)实验一:完成下表
操作步骤 | 现象 | 结论 |
甲同学的猜想不正确 |
实验二:按下图的实验装置,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的烧瓶中注入等体积、足量的稀盐酸,并测量生成二氧化碳的体积,记录如下表:

实验编号 | 锥形瓶内物质 | 最终得到CO2 体积/mL | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 0.8 | V1 |
② | 碳酸钠 | 0.8 | V2 |
③ | 白色粉末 | a | V1 |
(3)实验装置中植物油的作用是___;表中a= ___;V1____V2(填“>”、“<”或“=”)。
(分析并得出结论)(4)分析上表中数据得出结论:白色粉末的成分是__________,依据是______。
【题目】对稀硫酸的化学性质进行如下研究。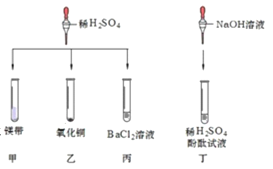
请回答下列问题:
①甲中观察到的现象是_____ ,反应的化学方程式为_________ ; 乙中反应的现象是 __________;
丙中反应的化学方程式为_____;丁中溶液由无色变成红色。
②当甲、乙试管内的固体完全溶解后,将两试管内的物质混合并加入过量的锌片、过滤,则滤渣的成分 是_________,滤液中溶质的化学式为___________。
③请设计能说明 NaOH 与H2SO4是否恰好中和的实验方案。(本题中所用过的试剂不能再用)
_______ | 实验步骤 | 实验现象 | 实验结论 |
_________ | _________ | _________ |
④实验结束后,将乙(其中固体全部溶解)、丁两个实验的废液倒入同一个干净的废液缸中,静置,最终看到上层清液呈红色,废液下层有沉淀。由此推断上层清液的成分有酚酞、水和_____。 写出生成下层沉淀物的化学方程式_____________。
通过上述实验可知,进行化学实验研究,除需要考虑生成什么物质外,还需要考虑_______。