题目内容
(2009?宁德)30℃时一杯饱和的硝酸钾溶液,欲使其变为不饱和溶液,下列操作可行的是( )
分析:根据常见固体物质的溶解度曲线可知:硝酸钾的溶解度受温度的影响较大;已知“饱和的硝酸钾溶液”,则可推测欲使其溶质的质量分数改变的可行操作.
解答:解:A、根据饱和的硝酸钾溶液的含义可知,加入硝酸钾晶体后,不再溶解,仍为饱和溶液,故A错误;
B、观察颜色不能使其变为不饱和溶液,故B错误;
C、根据硝酸钾的溶解随温度的升高而增大,增加温度到60℃,变为不饱和溶液,故C正确;
D、加水后,溶剂增多,可以将30℃时一杯饱和的硝酸钾溶液变为不饱和溶液,故D正确.
故选:CD.
B、观察颜色不能使其变为不饱和溶液,故B错误;
C、根据硝酸钾的溶解随温度的升高而增大,增加温度到60℃,变为不饱和溶液,故C正确;
D、加水后,溶剂增多,可以将30℃时一杯饱和的硝酸钾溶液变为不饱和溶液,故D正确.
故选:CD.
点评:本题注意考查了常见固体物质的饱和溶液和不饱和溶液的关系,学会处理有关问题.减少溶质、增加溶剂都能使溶液的溶质质量分数减小,而增加溶质、蒸发溶剂却不一定能使溶液的溶质质量分数增大.

练习册系列答案
相关题目
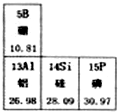 (2009?宁德)(1)用化学用语表示:
(2009?宁德)(1)用化学用语表示: 生产“达菲”的主要原料是莽草酸(如右图所示,莽草酸的化学式为C2H2O5).请根据信息回答:
生产“达菲”的主要原料是莽草酸(如右图所示,莽草酸的化学式为C2H2O5).请根据信息回答:
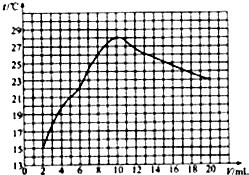
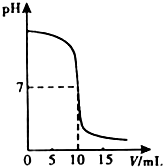 (2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.
(2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.