题目内容
(2009?宁德)在化学实验室发现一个盛有白色粉末的试剂瓶,其标签严重破损.这瓶试剂是氯化钠、碳酸钠、碳酸氢钠中的一种.通过查阅资料得知,常温下这三种物质的溶解度如下表:
(1)在常温下把10.6g的白色粉末加入100g水中,发现粉末全部溶解.由此可推断此溶液的溶质一定不是
(2)为确定其成分,对此溶液继续进行如下实验探究:
(3)取(1)中溶液的
与足量的氢氧化钠溶液反应,理论上能产生多少克氢氧化钠?[反应的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH].
| 物质 | NaCl | Na2CO3 | NaHCO3 |
| 溶解度/g | 35.9 | 21.5 | 9.6 |
NaHCO3
NaHCO3
.(2)为确定其成分,对此溶液继续进行如下实验探究:
| 实验步骤 | 实验现象 | 实验结论 |
取少量粉末于试管中,向里滴加稀盐酸 取少量粉末于试管中,向里滴加稀盐酸 |
有气泡生成 有气泡生成 |
该溶液是Na2CO3溶液 |
| 1 |
| 10 |
分析:(1)根据物质的溶解度判断;
(2)可根据碳酸钠能与酸反应生成二氧化碳气体分析;
(3)根据化学方程式进行计算,注意计算的步骤.
(2)可根据碳酸钠能与酸反应生成二氧化碳气体分析;
(3)根据化学方程式进行计算,注意计算的步骤.
解答:解:(1)根据三种物质的溶解度可看出,只有碳酸氢钠的溶解度小于10.6g,不能全部溶解;
(2)检验碳酸钠可根据碳酸盐能与盐酸反应生成二氧化碳气体的性质,取少量粉末加入盐酸,看是否能生成气体;
(3)根据化学方程式,由碳酸钠的质量可计算氢氧化钠的质量.
故答案为:.(1)NaHCO3 (2)
(3)解:设理论上能生成沉淀的质量为x
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
106 80
10.6g×
x
=
x=0.8g 答:理论上能生成沉淀的质量为0.8g
(2)检验碳酸钠可根据碳酸盐能与盐酸反应生成二氧化碳气体的性质,取少量粉末加入盐酸,看是否能生成气体;
(3)根据化学方程式,由碳酸钠的质量可计算氢氧化钠的质量.
故答案为:.(1)NaHCO3 (2)
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量粉末于试管中,向里滴加稀盐酸 | 有气泡生成 | 该溶液是Na2CO3溶液 |
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
106 80
10.6g×
| 1 |
| 10 |
| 106 |
| 1.06 |
| 80 |
| x |
x=0.8g 答:理论上能生成沉淀的质量为0.8g
点评:此题综合考查了常见物质的溶解度,检验碳酸盐的方法以及有关化学方程式的计算,都是重要的知识点,此题难度中等.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
 (2009?宁德)如右图所示,敞口量筒内的水放置一段时间之后,水会逐渐减少,这是由于( )
(2009?宁德)如右图所示,敞口量筒内的水放置一段时间之后,水会逐渐减少,这是由于( )
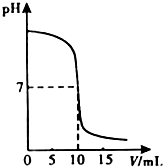 (2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.
(2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.