题目内容
为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几率试验数据如下:
|
试验次序 |
第1次 |
第2次 |
第3次 |
第4次 |
|
所取样品的质量/g |
50.0 |
50.0 |
50.0 |
50.0[ |
|
加入稀硫酸的质量/g |
20.0 |
40.0 |
60.0 |
80.0 |
|
生成气体的质量/g |
0.2 |
0.4 |
0.5 |
0.5 |
请回答下列问题并计算:
(1)经分析,在第1次实验结束后,反应物_________完全反应完了。
(2)50.0g样品与足量稀硫酸反应最多能生成气体_________g。
(3)计算样品中锌的质量分数(写出具体计算过程)。

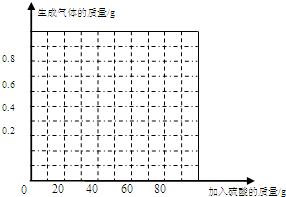
(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。
【答案】
(1)硫酸;(2)0.5;(3)32.5%(4)
【解析】
试题分析:(1)经分析,按照加入稀硫酸的比例第三次如果加入的硫酸完全反应则生成气体的质量应为0.6g,之所以为0.5g,是因为样品已经反应完了,所以在第1次实验结束后,反应物硫酸反应完了;(2)按照比例可知50.0g样品与足量稀硫酸反应最多能生成气体0.5g;(3)设样品中锌的质量为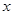 ,
,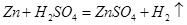
65 2
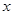 0.5g
0.5g
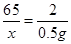 ,解得
,解得
样品中锌的质量分数为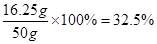
(1)由以上分析可知稀硫酸加入为50g时恰好将固体中的锌反应完,由表格中的数据可知,曲线为
考点:化学方程式的计算
点评:这是化学反应联系方程式的计算题,这种题目是每年中考的压轴题,必考题,这类题目的难点在于把坐标曲线表示的意义和题干联系起来。

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
为了测定某黄铜(铜锌合金)中锌的质量分数,某课外兴趣小组利用该合金与实验室中的一瓶稀硫酸反应,进行了若干次实验.现将其中的三次实验数据摘录如下:
请回答下列问题:
(1)第 次实验,黄铜中的锌与稀硫酸恰好完全反应.
(2)计算黄铜中锌的质量分数(写出计算过程).
| 实验次数 | 1 | 2 | 3 |
| 稀硫酸的质量(g) | 100 | 100 | 100 |
| 加入黄铜(铜锌合金)的质量(g) | 6.5 | 13 | 19.5 |
| 生氢气的质量(g) | 0.1 | 0.2 | 0.2 |
(1)第
(2)计算黄铜中锌的质量分数(写出计算过程).
 (2013?苏州模拟)为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几率试验数据如下:
(2013?苏州模拟)为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几率试验数据如下: