题目内容
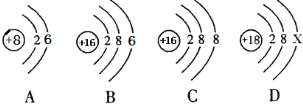
【题目】A~H是初中化学常见的8种物质,它们有下图所示的转化关系。已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰。
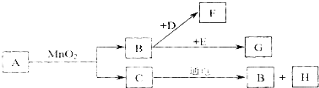
(1)推断物质的化学式:D ;G ;H 。(2)写出下列变化的化学符号表达式:
①B→F ;②B→G 。
【答案】(1)C SO2 H2 (2) C+O2![]() CO2 ②H2O
CO2 ②H2O![]() H2+O2
H2+O2
【解析】
试题分析:解答推断题抓住一些特殊的反应现象、特殊的性质及特殊的反应条件等级题目的“题眼”,物质C通电,说明C为水,结合图中的反应情况,B为氧气,H为氢气,F能使澄清石灰水变浑浊,D是黑色固体,说明D为碳单质,F为二氧化碳,E在纯净的B中燃烧发出明亮的蓝紫色火焰,E为单质硫,(1)下列物质的化学式: D为碳单质,符号为C,G为二氧化硫,符号为:SO2,H为氢气,符号为:H2
(2)①B → F反应的符号表达式:C+O2![]() CO2,②C → B反应的符号表达式:H2O
CO2,②C → B反应的符号表达式:H2O![]() H2+O2
H2+O2

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究 对反应速率的影响。
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小芳在实验时,误把氧化铜当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行如下探究:
【猜想Ⅰ】除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。
【设计实验】
按下表进行实验,并测定开始产生气体时的温度(提示:开始产生气体的温度越低,表示反应速度越快)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾和二氧化锰(质量比1︰1) | 350 |
氯酸钾和氧化铜(质量比1︰1) | 370 | |
氯酸钾和氧化铁(质量比1︰1) | 390 |
【数据和结论】
(1)由实验 与实验④对比,证明猜想合理;
(2)验所用的三种物质中,催化效果最好的是 。
【反思】
(1)若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的 和 是否改变。
小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ。
【猜想Ⅱ】过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应 (填“能”或“不能”)用于实验室制取氧气。
【分析与反思】
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为渔民用过氧化钙做增氧剂的主要原因是 。
(2)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议 。
(3)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气
你认为猜想 (填序号)一定是错误的,理由是 。
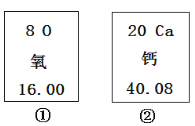
【计算】该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示。

试计算:
(1)过氧化钙的相对分子质量为 ;
(2)过氧化钙中钙元素与氧元素的质量比为 ;
(3)过氧化钙中钙元素质量分数为 ;
(4)该产品中过氧化钙的质量分数至少为 。