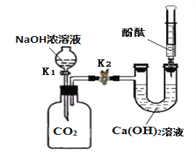
题目内容
【题目】某工厂欲从含有CuS04的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
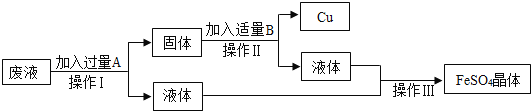
(1)操作Ⅰ的名称是______,需用到的玻璃仪器除烧杯之外还有______.
(2)加入过量A物质的化学式是______,A过量的目的是______,
反应的化学方程式是______.
(3)加入适量B物质的化学式是______.
【答案】 过滤 漏斗或玻璃棒 Fe 将CuSO4全部反应完 Fe+CuSO4==FeSO4+Cu H2SO4
【解析】(1)由操作过程可知.操作Ⅰ是将固液分离,操作名称是过滤,需用到的玻璃仪器除烧杯之外还有漏斗、玻璃棒;
(2)由于铁与硫酸铜反应生成铜和硫酸亚铁,铁与硫酸反应生成了硫酸亚铁和氢气,由题意可知,要回收铜和得到硫酸亚铁,应向废液中加入过量A物质是铁,将CuSO4全部反应完,化学方程式为:Fe+CuSO4=FeSO4+Cu;最后再加入过量的B应是稀硫酸,将过量的铁除去,所以A的化学式是Fe;
(3)由上述分析可知,加加入适量B物质的化学式是H2SO4。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如表:
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的pH |
① | 30g | pH<7 |
② | 40g | pH=7 |
③ | 50g | pH>7 |
请回答下列问题:
(1)欲计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号 的数据。
(2)若一定量石油产品中残余硫酸的质量为100g,请计算该残余硫酸的溶质质量分数(写出详细的计算过程)。