题目内容
2.学习化学需要学会一些基本的实验操作和实验原理方法.Ⅰ实验室制取氧气
实验室制取气体的常见的发生装置如图:
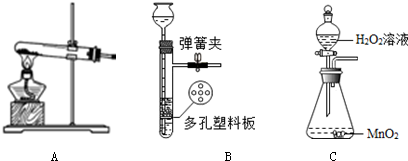
(1)实验室用加热高锰酸钾制取氧气的发生装置为A(填序号),发生反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,实验中发现水槽中的水变为紫色的原因是试管口没有放一团棉花.
(2)装置B的优点是能随时控制反应的发生和停止.
Ⅱ测定蔗糖的分子构成
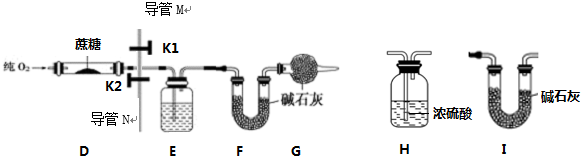
实验室用燃烧法测定蔗糖的分子构成,测定装置如图(固定装置铁架台、铁夹未画出):
【实验步骤】
①组装仪器,检验装置气密性.
②取17.1g 蔗糖放入装置D中,称量装置E、F的质量为m1,m2.
③缓慢地通入纯O2,检验空气被完全排尽后,连接装置E、F.
④加热装置D,蔗糖燃烧
⑤待观察到玻璃管中固体消失时,停止加热.
⑥缓慢地通入纯O2一段时间,称量装置E、F的质量为m3,m4.
【实验分析】
(3)步骤②中有关的称量操作,在具体称量步骤中的区别是称量装置E、F的质量时应该在密闭状态下进行,而称量蔗糖时不需要在密闭状态下进行.
(4)在A、B、C中,为达成步骤③⑥的目的,选择气体发生装置为C(填序号),并连接装置H、I中的H装置,得到纯净的O2,并可判断气流的速度.实验中保持装置D中O2足量的目的是使蔗糖完全燃烧生成水和二氧化碳.
(4)为使反应能够进行,装置图中缺少的常见仪器是酒精灯.E装置的作用是吸收反应生成的水蒸气;F装置的作用是吸收反应生成的二氧化碳;G装置的作用是防止空气中的水蒸气和二氧化碳进入F中.
(5)判断生成的气体被完全吸收的操作和现象是称量装置E、F的质量,质量不再增加.
(6)蔗糖完全燃烧生成CO2和H2O.通过该实验,能否确定蔗糖中是否含有氧原子?通过称量E、F装置的增重,可以知道反应生成水的质量和二氧化碳的质量,进一步可以计算氢元素、碳元素的质量,再根据蔗糖的质量可以判断定蔗糖中是否含有氧原子.若蔗糖的相对分子质量为342,E装置增重9.9g,F装置增重26.4g,求蔗糖的化学式(写出具体的计算过程).
【交流讨论】请回答下列有关问题:
(7)写出蔗糖在氧气中完全燃烧的化学方程式C12H22O11+12O2$\frac{\underline{\;点燃\;}}{\;}$12CO2+11H2O.
(8)检验步骤③中空气被排尽的方法是从导管N(填“M”或“N”)处收集气体,把带火星的木条放在集气瓶口,带火星的木条复燃.
(9)若略去步骤③,则测量结果的1个蔗糖分子中氧原子的个数偏小(填“偏小”、“不变”或“偏大”).若步骤⑥中,停止继续通入氧气的后果是会发生液体倒吸,炸裂玻璃管,并且测得的1个蔗糖分子中氧原子的个数偏大(填“偏小”、“不变”或“偏大”).
分析 Ⅰ、高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气;
为了防止高锰酸钾进入导管,通常在试管口塞一团棉花;
不同的实验装置,优缺点不同;
Ⅱ、凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
浓硫酸具有吸水性,碱石灰能够吸收水蒸气和二氧化碳;
通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
分液漏斗能够控制液体药品的流量,从而可以控制反应速率;
蔗糖完全燃烧生成水和二氧化碳;
氧气能使带火星的木条复燃;
如果操作不当,会影响实验结果,甚至会导致实验失败.
解答 解:Ⅰ、(1)实验室用加热高锰酸钾制取氧气的发生装置为A,发生反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,实验中发现水槽中的水变为紫色的原因是试管口没有放一团棉花.
故填:A;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;试管口没有放一团棉花.
(2)装置B的优点是能随时控制反应的发生和停止,原理是:关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止;
打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行.
故填:能随时控制反应的发生和停止.
Ⅱ、【实验步骤】
①组装仪器,检查装置气密性.
故填:检查装置气密性
⑤待观察到玻璃管中固体消失时,停止加热.
故填:玻璃管中固体消失.
【实验分析】
(3)步骤②中有关的称量操作,在具体称量步骤中的区别是:称量装置E、F的质量时应该在密闭状态下进行,而称量蔗糖时不需要在密闭状态下进行.
故填:称量装置E、F的质量时应该在密闭状态下进行,而称量蔗糖时不需要在密闭状态下进行.
(4)在A、B、C中,为达成步骤③⑥的目的,选择气体发生装置为C,并连接装置H、I中的H装置,得到纯净的O2,并可判断气流的速度.实验中保持装置D中O2足量的目的是使蔗糖完全燃烧生成水和二氧化碳.
故填:C;的H装置;使蔗糖完全燃烧生成水和二氧化碳.
(4)为使反应能够进行,装置图中缺少的常见仪器是酒精灯;
E装置的作用是吸收反应生成的水蒸气;
F装置的作用是吸收反应生成的二氧化碳;
G装置的作用是防止空气中的水蒸气和二氧化碳进入F中.
故填:酒精灯;吸收反应生成的水蒸气;吸收反应生成的二氧化碳;防止空气中的水蒸气和二氧化碳进入F中.
(5)判断生成的气体被完全吸收的操作和现象是称量装置E、F的质量,质量不再增加.
故填:称量装置E、F的质量,质量不再增加.
(6)通过称量E、F装置的增重,可以知道反应生成水的质量和二氧化碳的质量,进一步可以计算氢元素、碳元素的质量,再根据蔗糖的质量可以判断定蔗糖中是否含有氧原子.
故填:通过称量E、F装置的增重,可以知道反应生成水的质量和二氧化碳的质量,进一步可以计算氢元素、碳元素的质量,再根据蔗糖的质量可以判断定蔗糖中是否含有氧原子.
E装置增重9.9g,说明生成了9.9g水,其中氢元素质量为:9.9g×$\frac{2}{18}$×100%=1.1g,
F装置增重26.4g,说明生成了26.4g二氧化碳,其中碳元素质量为:26.4g×$\frac{12}{44}$×100%=7.2g,
17.1g蔗糖中氧元素质量为:17.1g-1.1g-7.2g=8.8g,
蔗糖中氢原子、碳原子和氧原子的个数比为:$\frac{1.1g}{1}$:$\frac{7.2g}{12}$:$\frac{8.8g}{16}$=22:12:11,
蔗糖的化学式为C12H22O11,相对分子质量为:(12×12)+(1×22)+(16×11)=342.
故答案为:C12H22O11.
【交流讨论】
(7)蔗糖在氧气中完全燃烧的化学方程式为:C12H22O11+12O2$\frac{\underline{\;点燃\;}}{\;}$12CO2+11H2O.
故填:C12H22O11+12O2$\frac{\underline{\;点燃\;}}{\;}$12CO2+11H2O.
(8)检验步骤③中空气被排尽的方法是从导管N处收集气体,把带火星的木条放在集气瓶口,带火星的木条复燃.
故填:N;把带火星的木条放在集气瓶口,带火星的木条复燃.
(9)若略去步骤③,则装置中的水蒸气和二氧化碳能被E、F装置吸收,导致计算的氢元素和碳元素质量偏大,从而导致测量结果的1个蔗糖分子中氧原子的个数偏小;
若步骤⑥中,停止继续通入氧气的后果是会发生液体倒吸,炸裂玻璃管,并且会导致生成的水蒸气和二氧化碳不能被完全吸收,从而导致计算的氢元素和碳元素质量偏小,进一步导致测得的1个蔗糖分子中氧原子的个数偏大.
故填:偏小;液体倒吸,炸裂玻璃管;偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 名校课堂系列答案
名校课堂系列答案| A. | 熟石灰Ca(OH)2 | B. | 火碱Na2CO3 | C. | 纯碱NaOH | D. | 胆矾CuSO4 |
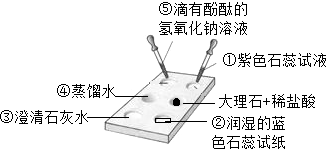 将一大烧杯倒扣在点滴板上,点滴板上所放物质如图所示,下列对有关实验现象的描述肯定不正确的是( )
将一大烧杯倒扣在点滴板上,点滴板上所放物质如图所示,下列对有关实验现象的描述肯定不正确的是( )| A. | ①处试液变蓝色 | B. | ②处试纸变红色 | C. | ③处溶液变浑浊 | D. | ④、⑤处无明显变化 |
| A. | NH4+、Na+、Cl-、CO32- | B. | B、Na+、K+、Cu2+、Cl- | ||
| C. | K+、Cl-、Mg2+、SO42- | D. | Ag+、NO3-、Mg2+、Cl- |