题目内容
12.实验室用分解氯酸钾的方法制取氧气.(1)用氯酸钾制取氧气的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
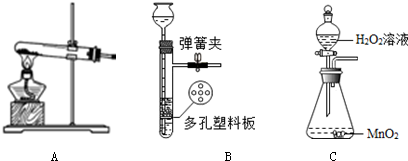
(2)现有下图所示的仪器,要制备并收集氧气,还需要补充的一种仪器是酒精灯;
(3)实验开始前检查装置气密性如图所示,如果导管口有气泡冒出说明气密性良好.

分析 (1)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,写出反应的化学方程式即可.
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,属于固体加热型制取气体,据此进行分析解答.
(3)根据检查装置气密性的方法,进行分析解答.
解答 解:(1)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,属于固体加热型制取气体,要制备并收集氧气,还需要补充的一种仪器是酒精灯.
(3)检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气.
故答案为:(1)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;(2)酒精灯;(3)导管口有气泡冒出.
点评 本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取氧气的反应原理、发生装置的选择依据等是正确解答本题的关键.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
3.下列变化过程中只发生了物理变化的是( )
| A. | 动植物呼吸 | B. | 食醋除水垢 | C. | 干冰升华 | D. | SO2形成酸雨 |
20.下列有关纯碱的说法正确的是( )
| A. | 纯碱难溶于水 | |
| B. | 纯碱就是纯度比较高的碱 | |
| C. | 纯碱中含有少量的小苏打可以用稀盐酸除去 | |
| D. | 纯碱既可以从内陆盐湖提取,又可用“侯氏联合制碱法”生产 |
17.由+2价的X和-1价的Y两种元素组成的化合物的化学式为( )
| A. | XY2 | B. | X2Y | C. | YX2 | D. | Y2X |
19.鉴别下列各组物质,所选用的试剂正确的是C
| 被鉴别的物质 | 选用试剂 | |
| A | 氢氧化钠溶液和澄清石灰水 | 稀盐酸 |
| B | 氯化钠溶液和稀盐酸 | 无色酚酞 |
| C | 硝酸铵固体和氢氧化钠固体 | 水 |
| D | 氯化钾固体与硫酸铵固体 | 氢氧化钙 |
20.关于过氧化氢(H2O2)的叙述中,正确的是( )
| A. | 由氢氧两种元素组成的化合物 | |
| B. | 由一个个水分子和一个氧原子构成 | |
| C. | 过氧化氢分子由氢分子和氧分子构成 | |
| D. | 其中氢元素和氧元素之间的质量比为1:1 |