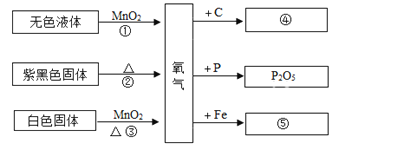
题目内容
【题目】在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂。为了确定该干燥剂的组成,同学们进行了如下的探究活动:
小萌同学通过探究发现,此包装袋中的生石灰干燥剂已经完全变质失效。他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象。此实验中加入的水必须是少量的,理由是________________________。
(查阅资料)
石灰干燥剂的成分为CaO,请写出该干燥剂干燥原理____________(用化学方程式表示)。
(提出猜想)①该干燥剂的成分为Ca(OH)2
②该干燥剂的成分为CaCO3
③你的猜想是__________________;
(方案设计)小组成员设计了如下的实验方案:
方案一:取样滴加稀盐酸,有气泡产生,则白色固体只存在CaCO3;
方案二:取样滴加少量稀盐酸,没有气泡产生,则白色固体中只存在Ca(OH)2 ;
方案三:取样加入水中,振荡,静置,上层为清液,下层出现固体不溶物,取上层清液滴加酚酞试液,变红,则固体为CaCO3和Ca(OH)2的混合物。
(实验分析)小组成员经过讨论发现上述实验方案都存在着问题。
上述方案一中存在的问题是__________________。
上述方案二的结论是错误的,原因是_______________________________________。
(3)实验方案三中的结论也有些不妥,是因为____。
(4)实验证实,该固体是CaCO3和Ca(OH)2的混合物,请你再设计一种实验方案予以证明,只要写出实验步骤和现象即可。
实验操作步骤 | 实验现象 |
____ | ____ |
(数据分析)
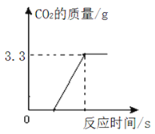
为了进一步确定该混合物中CaCO3的质量分数,实验小组的同学取了15克样品,加入足量的稀盐酸,实验测得生成CO2气体的质量如图所示,请据图计算该混合物中CaCO3的质量分数。____
(反思与评价)
实验中造成计算结果与实际值相比偏小,则可能的原因是________________________
【答案】水太多会吸热会影响实验结果 CaO+H2O=Ca(OH)2 CaCO3、Ca(OH)2 不能说明白色固体中是否含有Ca(OH)2 由于加入的盐酸是少量的,可能只是与氢氧化钙发生了反应,还没有与碳酸钙反应,无法证明没有碳酸钙的存在 不能说明白色固体中含有CaCO3 ,因为不溶物可能是微溶于水的氢氧化钙。 取样,滴加足量稀盐酸;另取适量的样品,加足量的水溶解,静置取上层清液,滴加酚酞试液 产生大量的气泡;溶液呈红色 50% 有部分生成的二氧化碳气体因溶解于水而没有全部逸出或装置的气密性不好(只要合理就行)
【解析】
此实验中加入的水必须是少量的,理由是水太多时会吸收较多的热量,从而使放热现象不明显;
结论与反思:氧化钙和水反应生成氢氧化钙,化学方程式表示为:CaO+H2O=Ca(OH)2;
提出猜想:①该干燥剂的成分为Ca(OH)2;②该干燥剂的成分为CaCO3;③你的猜想是CaCO3、Ca(OH)2;
实验(1)因为加入足量的稀盐酸,有无色无味的气体产生,该气体能使澄清的石灰水变浑浊,说明是二氧化碳,进一步说明干燥剂中含有碳酸钙,氢氧化钙和稀盐酸反应生成氯化钙和水,无现象,不能说明白色固体中是否含有Ca(OH)2;
(2)由于加入的盐酸是少量的,可能只是与氢氧化钙发生了反应,还没有与碳酸钙反应,无法证明没有碳酸钙的存在;
(3)由于氢氧化钙是微溶物,取样加入水中,振荡,静置,上层为清液,下层出现固体不溶物,取上层清液滴加酚酞试液,变红,不能说明白色固体中含有CaCO3,因为不溶物可能是微溶于水的氢氧化钙;
(4)取样,滴加足量稀盐酸,产生大量的气泡,说明含有碳酸钙;另取适量的样品,加足量的水溶解,静置取上层清液,滴加酚酞试液,溶液呈红色,说明含有氢氧化钙;
数据由图中数据可知,生成二氧化碳的质量是3.3g,设碳酸钙的质量为x,
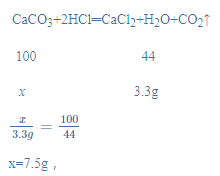
该水垢样品中CaCO3的质量分数:![]() ×100%=50%;
×100%=50%;
反思与评价:二氧化碳因溶解于水而没有全部逸出,导致二氧化碳的质量偏小,从而求出碳酸钙的质量偏小,所以会导致造成计算结果与实际值相比偏小。

 名校课堂系列答案
名校课堂系列答案