题目内容
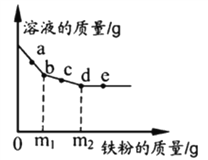
【题目】如图为KNO3和NaCl两种物质的溶解度曲线。
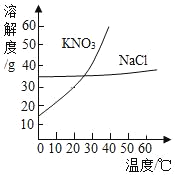
(1)在溶质的质量和质量分数不变的条件下,将40℃接近饱和的KNO3溶液转化为饱和溶液,应采用的方法是_____;
(2)20℃时,将40克KNO3放入100克水中,充分溶解后还剩8.4克KNO3,则20℃时的KNO3溶解度为_____g。
(3)若NaCl溶液中混有少量的KNO3,提纯NaCl的方法是_____。
【答案】降低温度 31.6 蒸发结晶
【解析】
(1)在溶质的质量和质量分数不变的条件下,将40℃接近饱和的KNO3溶液转化为饱和溶液,应采用的方法是:降低温度;
(2)固体溶解度的概念是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量。20℃时的KNO3溶解度=40g-8.4g=31.6g;
(3)根据题目信息和溶解度曲线可知:KNO3和NaCl两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钠大。若NaCl溶液中混有少量的KNO3,提纯NaCl的方法是蒸发结晶。

 名师点睛字词句段篇系列答案
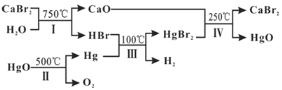
名师点睛字词句段篇系列答案【题目】某兴趣小组在空气中点燃镁条时发现:生成的白色固体物质中夹杂着少量的淡黄色固体。为了探究其原因,小组成员进行了以下探究活动:
(提出问题)淡黄色固体物质的成分是什么?
(查阅资料通过查阅资料,记录了下列几种物质的颜色:
物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
小组成员一致认为产物中一定不含有氯化镁,理由是______。
(提出猜想)淡黄色的固体可能是______。
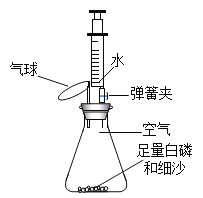
(实验探究](1)按如图所示装置收集氮气
①关闭a、b、c,用凸透镜聚光引燃白磷,待白磷不再燃烧并冷却至室温。
②打开a、b,使用打气筒进行充气,A中的水进入B时,打开c,继续充气。C中收集到N2.选用排水法收集氮气的原因是______。
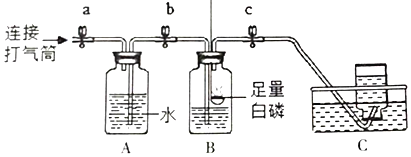
(2)实验验证的方法是将燃烧的镁条伸入集气瓶,若观察到______现象,则证明淡黄色固体是Mg3N2。
(实验结论)猜想是正确的,镁条在空气中燃烧的有关化学反应方程式是______。
(实验反思)本探究活动对物质燃烧新的认识是______。