题目内容
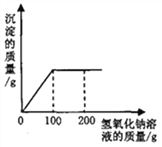
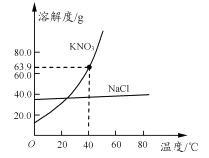
【题目】甲、乙两种物质的溶解度曲线如图所示,下列叙述错误的是( )
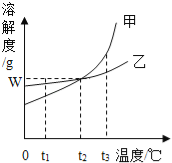
A. t1℃时,甲的溶解度小于乙的溶解度
B. t1℃时,加入甲物质,可使不饱和的甲溶液变成饱和
C. t2℃时,甲或乙两种物质饱和溶液中溶质与溶剂的比是W:100
D. 将甲、乙饱和溶液的温度从t3℃降到t2℃时,乙先析出晶体
【答案】D
【解析】试题分析:溶解度曲线意义:1、表示某物质在不同温度下的溶解度或溶解度随温度变化的情况,进而判断结晶的方法,①溶解度随温度的升高而增大,采用冷却热饱和溶液(即降温结晶),②溶解度随温度的升高而变化不大,采用蒸发结晶,2、两曲线的交点表示两种溶质在同一温度下具有相同的溶解度,3、可比较同温下,不同物质溶解度的大小关系,4、可直接读出某温下,物质的溶解度; A、t1℃时,甲的溶解度小于乙的溶解度,正确,B、要将不饱和溶液变为饱和溶液,那么最可靠的方法就是继续加入溶质,所以t1℃时,加入甲物质,可使不饱和的甲溶液变成饱和,正确,C、t2℃时,甲或乙两种物质的溶解度相等,都为w克,所以此时甲或乙两种物质饱和溶液中溶质与溶剂的比是W:100,正确,D、甲的溶解度随温度变化的趋势更大,所以将甲、乙饱和溶液的温度从t3℃降到t2℃时,甲先析出晶体,错误,故选D

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】兴趣小组的同学对铝的某些性质进行相关探究。
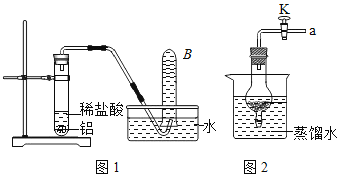
(实验回顾)(1)铝与稀盐酸反应。
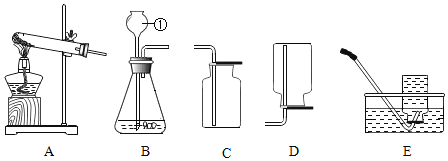
①用如图1所示装置制取氢气。
铝与稀盐酸反应的化学方程式为______。
②用B装置收集氢气的原因是______。
(2)在金属活动性顺序里,金属能否置换出盐酸和稀硫酸中的氢,判断的依据是____________。
(提出问题)铝能否与水反应生成氢气?
(查阅资料)
物质 | 钠与水 | 铝与水 | 汞与水 |
能否发生反应 | 能反应 | 能反应 | 不反应 |
(交流与讨论)
(1)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,起到保护膜的作用,如生活中可用铝壶烧水。铝与氧气反应的化学方程式为____________。
(2)除去铝表面氧化铝薄膜的方法:_________(举一例)。
(实验探究)
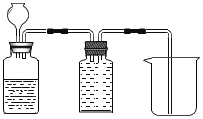
(1)将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,立即用流水冲洗干净后加入蒸馏水中(如图),其表面生成大量气泡、周围出现白色沉淀。铝与氯化汞溶液发生置换反应的化学方程式为_____。
(2)在导管口a处涂肥皂水,发现导管口有气泡形成,当气泡离开导管后,气泡______(填“下沉”或“上升”),用燃着的木条点燃气泡,发出爆鸣声。
(实验结论)铝能与水反应生成氢气。写出铝与水反应生成氢氧化铝和氢气的化学方程式:______。
(实验反思)(1)图2装置内,在铝与水反应的过程中,若关闭导管上的活塞K,反应停止,其原理是____________。当再次打开活塞K,反应继续,产生气泡。铝未能变成氧化铝,其原因是______。
(2)汞有毒,会污染环境,兴趣小组的同学用硫粉处理单质汞发生的化合反应方程式为:________