��Ŀ����
����Ŀ��ijʳ������ȡ���������ǧ��������Ϊԭ�ϣ����Ƚ����վ��ƶ��ɣ�
��1����ʵ��������5.0g�������ܽ⡢���˺��Ȳ��裬�����ᴿ�õ�4.0g���Σ������Ϊ��%��
��2��ÿ�ٿ�ʳ�����л������������軯��1mg���������ǣ� ��
��3������һ�����ô����ξ������õ�ʳ���Σ�����Ҫ�ɷ֣������������ƣ����Ȼ���60.0%���Ȼ���40.0%������ʽ�������ʳ��������Ԫ�����������ȴ��Ȼ�������Ԫ�ص����������Ͷ��٣���������ȷ��0.1%����
���𰸡�
��1��������80
��2��Ԥ��ȱ����ƶѪ
��3���⣺����ʳ��������Ԫ�����������ȴ��Ȼ�������Ԫ�ص����������ͣ� ![]() ��100%��
��100%�� ![]() ��100%��60%=
��100%��60%= ![]() ��100%��1��60%����15.7%
��100%��1��60%����15.7%
���������⣺��1������5.0g�������ܽ⡢���˺������Ȳ��裬�����ᴿ�õ�4.0g���Σ������Ϊ�� ![]() =80%����2����ʳ���������������軯�ص������ǣ�Ԥ��ȱ����ƶѪ��
=80%����2����ʳ���������������軯�ص������ǣ�Ԥ��ȱ����ƶѪ��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��ij���������������ͿĨ��ɫ��ĩA���ӳ�����ʱ�䣮С�½���������ʵ�飬̽��������A�Ļ�ѧ��ɣ�
��1�����������
���� | ʵ����� | ʵ������ |
�� | ȡ�����Թ��У�����������ˮ���� | ��Ʒ��ʧ���õ���ɫ������Һ |
�� | �����������Һ�еμ���ɫ��̪��Һ | ��Һ��� |
�� | �����������Һ�еμ�ϡ���������� | ������ɫ�������µ����壬��Һ��ɫ |
��������ʵ��ɳ�����֪��A����
��2�����������
Ϊ��һ��̽��A�Ļ�ѧ��ɣ���������ʵ�飺
�ٽ�ʢ��292g��������Ϊ12.5%��ϡ�����װ�����ڵ�����ƽ�ϣ���װ�ÿ�ȷ���Ȼ����ˮ�������ݳ�����
����װ���м���2.0gA������ƽ�������ٱ仯ʱ��¼���ݣ�
���ظ������ɴΣ�
����mA������A��������Ϊ�����ꡢ�ԡ�m����Һ�����أ�Ϊ�����꣬�����ͼ��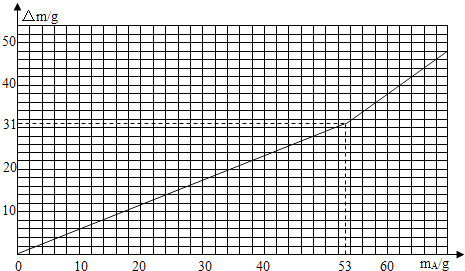
ͨ������ش��������⣺
��ʵ���з�Ӧ���ɵ������������Ϊ g��
��A�������������������������������Ϊ ��
��A�Ļ�ѧʽΪ ��