题目内容
(10分)以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
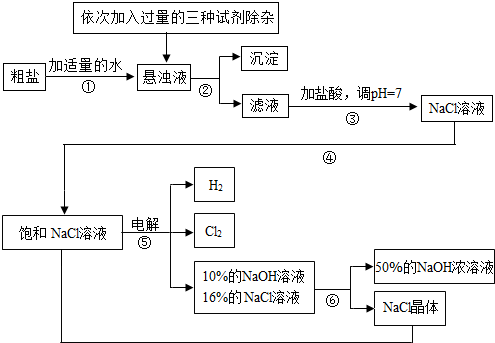
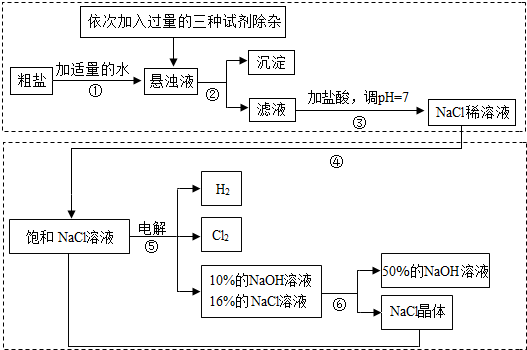
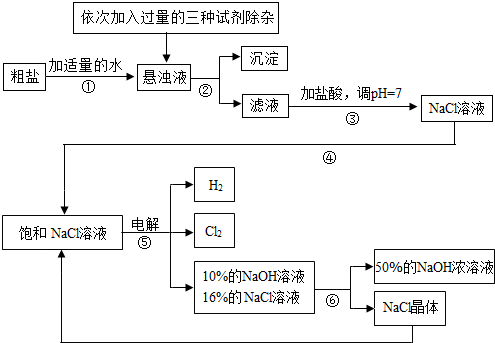
Ⅰ.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制。下图是粗盐精制的流程: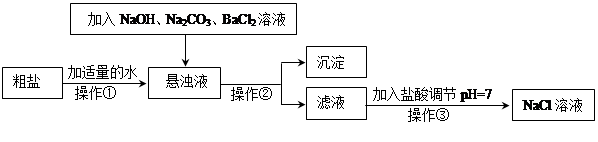 回答下列问题:
回答下列问题:
(1)操作②的名称是 。
(2)在悬浊液中加NaOH溶液、Na2CO3溶液、BaCl2溶液三种试剂的顺序合理的为 。
| A.先加入NaOH,后加入Na2CO3,再加入BaCl2溶液 |
| B.先加入NaOH,后加入BaCl2溶液,再加入Na2CO3 |
| C.先加入BaCl2溶液,后加入NaOH,再加入Na2CO3 |
| D.先加入BaCl2溶液,后加入Na2CO3,再加入NaOH |
Ⅱ.下图是电解食盐水制取氯气、氢氧化钠等产品的流程:
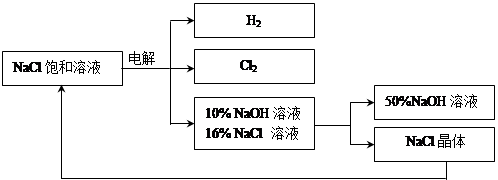
(3)在电解过程中,发生的反应为2NaCl + 2H2O
 Cl2 ↑+ H2 ↑ + 2NaOH,电解后溶液的pH 。(填“升高”、“不变”、“降低”)
Cl2 ↑+ H2 ↑ + 2NaOH,电解后溶液的pH 。(填“升高”、“不变”、“降低”)(4) 电解食盐水时,需防止Cl2和NaOH反应,因Cl2和NaOH溶液充分接触会生成NaClO、氯化钠、水,请写出Cl2和NaOH溶液反应的化学方程式 。
(5)该流程中可以循环利用的物质是 。
(6)若取100g的溶质质量分数为25%的氯化钠溶液进行电解,一段时间后停止通电,生成氯气的质量7.1g。请计算:生成氢气的质量为多少克?反应后溶液中NaOH的质量分数是多少?(写出计算过程,计算结果精确到0.1%)
(7)若使(6)中电解后的溶液恢复到原来状态,则需向溶液中加入适量的 。
Ⅰ.(1)过滤(1分) (2) BCD (1分,答对2个给0.5分,答对3个给1分。)Ba(OH)2 (1分)
Ⅱ.(3)升高(1分) (4) 2NaOH + Cl2 ="==" NaClO+NaCl + H2O (1分)
(5) NaCl(1分)
(6)解: 设:生成氢气的质量为x,氢氧化钠的质量为y
2NaCl + 2H2O Cl2 ↑+ H2 ↑+ 2NaOH
Cl2 ↑+ H2 ↑+ 2NaOH
117 71 2 80
7.1g x y  X="0.2" g ( 1分 )
X="0.2" g ( 1分 )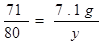 y ="8" g ( 1分 )
y ="8" g ( 1分 )
反应后所得溶液中溶质质量分数: ( 1分 )
( 1分 )
(7) HCl或氯化氢 (1分)
解析

练习册系列答案
相关题目