题目内容
【题目】下列是人体中几种体液的正常pH值,酸性最强的是
A.胆汁(6.8~7.4)B.唾液(6.6~7.1) C.血液( 7.35~7.45) D.胃液(0.8~1.5)
【答案】D
【解析】
试题分析:溶液的pH值小于7时溶液显酸性,且pH值越小酸性越强,以此判断酸性最强的为胃液,答案选择D

【题目】某化学兴趣小组对一包干燥的红色粉末组成进行探究.请你参与并回答有关问题.
(1)【教师提醒】它由Cu、Fe2O3二种固体中的一种或两种组成. 【提出猜想】红色粉末可能的组成有:①只有Cu;②只有;③是Cu、Fe2O3的混合物
【资料获悉】Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2
【实验探究】
甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解.甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为的观点正确(填“甲”或“乙”).
(2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应后 | |
Ⅰ组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
Ⅱ组 | 洗气瓶和所盛溶液的总质量为180.0g | 洗气瓶和瓶中物质的总质量为183.1g |
【交流讨论】
在装置A中先通CO气体的作用是 .
(3)应该选择组的实验数据计算来确定红色粉末的组成.最终计算结果表明:该红色粉末的组成是猜想中的第组(填序号).
(4)写出A装置中发生反应的化学方程式;实验中观察到A装置中的现象为 . 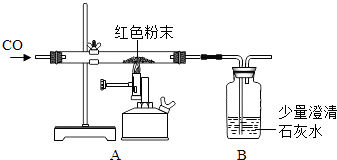
(5)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?(填“需要”或“不需要”),理由是 .
(6)【反思评价】丁同学指出:从环保角度,如图装置有严重不足之处.你认为应该如何改进? .