题目内容
【题目】A、B、C、D四种化合物,由以下8种离子构成(每种离子只能选用一次)。
阳离子:Na+、Ba2+、Cu2+、Mg2+; 阴离子;Cl、NO3-、OH、SO42-
四种化合物之间的反应有如下现象:
①A![]() B→白色沉淀,不溶于硝酸;
B→白色沉淀,不溶于硝酸;
②B![]() D→蓝色沉淀:
D→蓝色沉淀:
③C![]() B→白色沉淀,再加硝酸沉淀则转化为C。
B→白色沉淀,再加硝酸沉淀则转化为C。
(1)由此可推知:A为__________,D为__________。(填化学式)
(2)请写出B![]() C反应的化学方程式___________________。
C反应的化学方程式___________________。
【答案】Na2SO4 CuCl2 2HNO3+Mg(OH)2=Mg(NO3)2+2H2O
【解析】
题目中的突破口“A+B→白色沉淀,不溶于硝酸”,则为Ba2+和SO42-反应生成硫酸钡沉淀;根据“B+D→蓝色沉淀”,则为Cu2+和OH-作用生成氢氧化铜沉淀;“C+B→白色沉淀,再加硝酸沉淀则转化为C”,则可推测生成的沉淀为不溶性碱氢氧化镁,而C为硝酸镁。又因为“每种离子只能选用一次”,每个物质只有一种可能,所以推测出各物质,带入验证符合题意即可。
根据“A+B→白色沉淀,不溶于硝酸”,则为Ba2+和SO42-反应生成硫酸钡沉淀,则推测A可能为硫酸钠;B为氢氧化钡;化学方程式为:Ba(OH)2+Na2SO4=BaSO4↓+2NaOH;
根据“B+D→蓝色沉淀”,则为Cu2+和OH-作用生成氢氧化铜沉淀;则推测B为氢氧化钡,而D为氯化铜;化学方程式为:CuCl2+Ba(OH)2=Cu(OH)2↓+BaCl2;
根据“C+B→白色沉淀,再加硝酸沉淀则转化为C”,则可推测生成的沉淀为不溶性碱氢氧化镁,而C为硝酸镁;化学方程式为:Mg(NO3)2+Ba(OH)2=Ba(NO3)2+Mg(OH)2↓;2HNO3+Mg(OH)2=Mg(NO3)2+2H2O
故A为硫酸钠,B为氢氧化钡,C为硝酸镁,D为氯化铜。
故答案为:
(1)Na2SO4,CuCl2.(2)2HNO3+Mg(OH)2=Mg(NO3)2+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)小明在帮老师整理实验室时,发现一瓶未密封的NaOH固体,对其成分提出以下假设,并在老师的指导下进行实验探究
(查阅资料):①NaOH暴露在空气中易变质请用化学方程式解释NaOH变质的原因_____
②Na2CO3溶液呈碱性,BaCl2溶液NaCl溶液呈中性
(猜想假设):假设I:只含NaOH;假设Ⅱ:含NaOH和Na2CO3;假设Ⅲ:只含Na2CO3
(进行实验):
实验操作步骤 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设_____不正确 |
②另取少量样品于试管中,加水溶解,加入 过量的BaCl2溶液,振荡,静置 | _____ | 假设Ⅲ正确 |
③取②中上层清液,滴加无色酚酞溶液 | _____ |
(问题讨论):步骤②中加入过量BaCl2溶液的作用是_____,如将②中BaCl2溶液换成Ba(OH)2溶液,实验能否成功?_____(填“能”或“不能”),原因是_____
(2)小红为了测定一瓶未密封保存已部分变质的NaOH固体中NaOH的质量分数,采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;
②在样品溶液中加入足量的BaCl2溶液;
③待反应完全后,过滤有关数据记录如下表:
反应前 | 反应后 | |
烧杯和样品溶液总质量/g | 加入氯化钡溶液质量/g | 过滤后烧杯和溶液总质量/g(滤液的损失忽略不计) |
95 | 65 | 140.3 |
请回答下列问题:
①在反应前后的溶液中,下列元素质量保持不变的是_____
A钠元素 B碳元素 C钡元素 D氧元素
②原样品中NaOH的质量分数是多少?(写出计算过程)_____
【题目】宏观和微观相结合是认识物质结构的有效方法之一。
已知:X、Y、Z、W四种粒子的核电荷数及核外各电子层电子排布情况如下表。
X | Y | Z | W | U | ||
对应元素名称 | 氧 | 镁 | 铝 | 氯 | 氩 | |
核电荷数 | 8 | 12 | 13 | 17 | 18 | |
电子层 | 第一层 | 2 | 2 | 2 | 2 | 2 |
第二层 | 6 | 8 | 8 | 8 | 8 | |
第三层 | a | 8 | 8 | |||
请回答下列问题
(1)若Z表示原子,a=_______。 单质X2与单质Z的反应中,Z原子______(填“得到”或“失去”电子。
(2)具有相对稳定结构的原子是_______(填粒子符号)
(3)Y、W形成的化合物溶解于水形成的水溶液易导电,因为该化合物溶解于水会解离出_____________(用离子符号表示)。
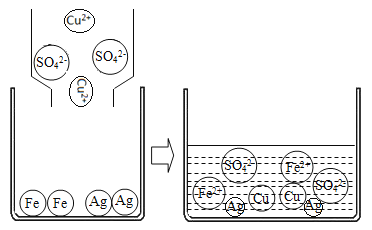
(4)将硫酸铜溶液与烧杯中Fe、Ag两种金属相混合,微观变化情况如图:则变化过程中的微观反应实质是___________,并写出本质相同的另一个化学反应方程式_____________(反应物之一必须为铁)。