题目内容
【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂。下面是对硫酸的性质、制取、用途等方面的探究,请你共同参与并回答有关问题。
(探究一)硫酸的性质
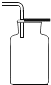
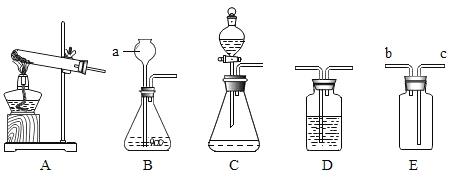
(1)浓硫酸稀释过程如图1所示,b中盛放的物质是_______。
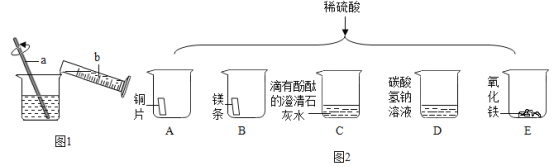
(2)如图2将适量的稀硫酸分别加入A~E五只烧杯中。有气泡产生的是_____,证明C中发生化学反应的现象是__________。
(探究二)硫酸的工业制法
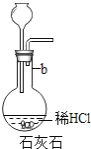
工业上以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程如图所示,其中沸腾炉内发生的主要反应是:4FeS2 +11O2 ![]() 2Fe2O3 +8SO2 。
2Fe2O3 +8SO2 。
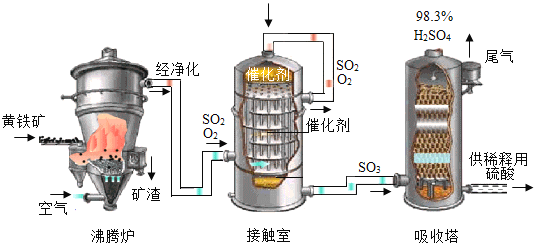
(1)接触室中发生的化学方程式为___________。
(2)依据生产硫酸的工艺流程图,下列说法正确的是_____(填字母序号)。
A 为使黄铁矿充分燃烧,需将其粉碎
B 沸腾炉排出的矿渣可供炼铁
C 催化剂能够提高SO2的反应速率和产量
D 吸收塔中98.3%的硫酸从顶部喷洒,增大接触面积,有利于吸收SO3
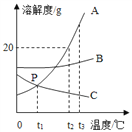
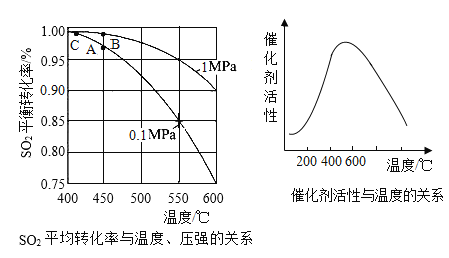
(3)接触室中的SO2平衡转化率与温度及压强的关系如图所示,催化剂活性与温度的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃(对应图中A点),而没有选择SO2转化率更高的C点对应的反应条件,其原因是_________。
(探究三)探究某黄铁矿中FeS2的含量。
同学们进行了如下实验探究。
(查阅资料)Na2SO3 +H2O2 =Na2SO4 +H2O
(实验探究)
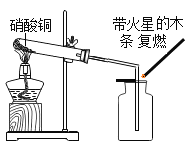
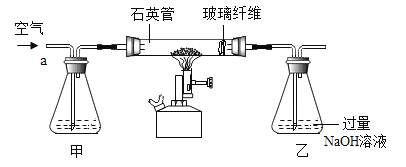
Ⅰ称取1.60g黄铁矿样品放入如图所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应(同工业上沸腾炉内的反应)。
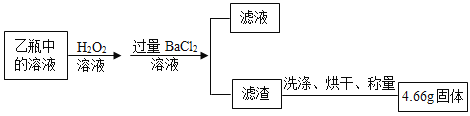
Ⅱ反应结束后,将乙瓶中的溶液进行如图处理。
(问题讨论)I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是_____。
(含量测定)计算该黄铁矿中FeS2的质量分数为_____。(写出计算过程)
【答案】浓硫酸 BD 溶液由红色变无色 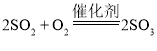 ABD C点对应的温度低,催化剂活性低,反应速率也慢 吸收空气中的二氧化碳,防止干扰实验 75%
ABD C点对应的温度低,催化剂活性低,反应速率也慢 吸收空气中的二氧化碳,防止干扰实验 75%
【解析】
探究一:(1)浓硫酸稀释是将浓硫酸沿烧杯壁缓缓加入盛有水的烧杯中,并不断用玻璃棒搅拌,所以量筒中盛放的是浓硫酸;
(2)铜片和稀硫酸不反应,镁条和稀硫酸反应生成氢气和硫酸镁,氢氧化钙和稀硫酸反应生成硫酸钙和水,碳酸氢钠和稀硫酸反应生成硫酸钠、二氧化碳和水,氧化镁和稀硫酸反应生成硫酸镁和水,所以有气泡产生的是BD;C中氢氧化钙和稀硫酸反应生成硫酸钙和水,溶液由碱性变为中性,溶液由红色变无色。
探究二:(1)从图中信息可知,接触室中二氧化硫和氧气反应生成三氧化硫,化学方程式为: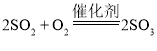 ;
;
(2)将黄铁矿粉碎,增大了接触面积,可以使黄铁矿充分燃烧,A正确;沸腾炉排出的矿渣是氧化铁,可供炼铁,B正确;催化剂只能够提高SO2的反应速率,不能提高产量,C错误;吸收塔中98.3%的硫酸从顶部喷洒,增大接触面积,有利于吸收SO3,D正确;故选ABD;
(3)根据图像分析,温度越高,二氧化硫的转化率越高;催化剂的活性随温度升高,先增大后减小。在实际生产中,会选用A点对应的反应条件而非C点,是因为C点对应的温度低,催化剂活性低,反应速率也慢。
探究三:将空气通入装置甲,甲中盛有氢氧化钠溶液,将空气中的二氧化碳吸收,因为装置最后需要用氢氧化钠溶液吸收二氧化硫,所以必须防止二氧化碳干扰试验,氧气和黄铁矿在高温条件下反应生成氧化铁和二氧化硫,最后用氢氧化钠溶液吸收二氧化硫。所以I中装置甲瓶的作用是吸收空气中的二氧化碳,防止干扰实验;
洗涤烘干得到的固体是硫酸钡,设样品中FeS2的质量为x。
根据化学方程式: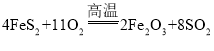 、
、![]() 、
、![]() 、
、 ![]() 可得如下关系:
可得如下关系:
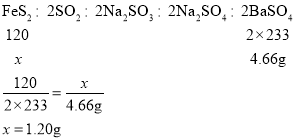
则黄铁矿中FeS2的质量分数![]()

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】根据下图回答问题:
实验内容 | 读出量筒液体的体积数 | 向上排空气法收集气体 | 实验室制CO2 | 过滤 | 加热液体药品 |
实验操作图 |
|
|
|
|
|
实验操作图编号 | A | B | C | D | E |
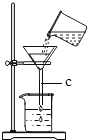
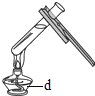
(1)写出上表实验操作图中标有字母d的仪器名称:_____.
(2)上表的实验操作图中有错误的是_____![]() 填番号,下同
填番号,下同![]() 其中_____图中的操作,造成液体沸腾后冲出
其中_____图中的操作,造成液体沸腾后冲出![]() 图中的操作,会造成_____.
图中的操作,会造成_____.