题目内容
【题目】某同学设计如下实验,测定某品牌碳酸饮料中CO2的含量,设计如下实验步骤:
①将250mL瓶装碳酸饮料放在冰箱中冷冻一段时间(未结冰);
②将饮料从冰箱内取出,迅速加入质量分数为50%NaOH溶液5mL;倒转饮料瓶轻轻振荡, 然后放置恢复至室温,作待测液;
③按右图连接实验装置。取50mL 待测液置于装置B的锥形瓶中,关闭开关K,打开分液漏斗的活塞,向锥形瓶中注人稀硫酸,至不再产生气泡,关闭活塞;
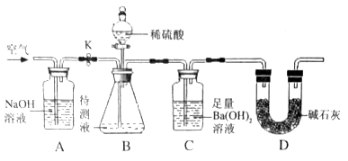
④打开开关K,向装置中鼓人空气,一段时间后,将C装置中的物质过滤,洗涤,烘干称量质量为0.394g。
资料:①CO2与足量Ba(OH)2反应生成BaCO3沉淀。②碱石灰是CaO与NaOH的固体混合物。③实验中各种溶液的密度都视为lg/mL。
根据以上实验过程完成下列问題:
(1)上述实验过程中,C装置中的现象是_________;
(2)装置A中发生的化学反应方程式为_______,装置D的目的是_______;
(3)步骤①冷冻碳酸饮料的目的是_______;
(4)步骤④鼓入空气的目的是_______;
(5)根据题中提供的数据计算此品牌碳酸饮料中CO2的含量为_______g/L(加入的NaOH溶液的体积可忽略不计)。
【答案】(1)冒气泡,溶液变浑浊;
(2)CO2+2NaOH=Na2CO3+H2O;防止空气中的二氧化碳进入C装置,干扰实验结果;
(3)防止二氧化碳逸出;(4)将产生的二氧化碳全部排入C中完全吸收;(5)1.76.
【解析】(1)打开开关K,向装置中鼓入空气,一段时间后,装置B中生成的二氧化碳完全进入装置C中,由于CO2与足量Ba(OH)2反应生成BaCO3沉淀,故装置C中的现象是冒气泡,溶液变浑浊;(2)空气中的二氧化碳能与氢氧化钠溶液反应,装置A中发生化学反应的方程式为CO2+2NaOH=Na2CO3+H2O;装置D的目的是防止空气中的二氧化碳进入C装置,干扰实验结果。(3)温度越低,气体的溶解度越小。(4)步骤④鼓入空气的目的是将产生的二氧化碳全部排入C中完全吸收;(5)设此品牌碳酸饮料中CO2的质量为x,CO2+Ba(OH)2==BaCO3↓+H2O
44 197
x 0.394g
![]() =
=![]() 解得x= 0.088g
解得x= 0.088g
50mL=0.05L,此品牌碳酸饮料中CO2的含量为:![]() =1.76g/L
=1.76g/L